Огнемет реформ в Центре табачных изделий FDA
Подход FDA к регулированию табака и никотина должен стать приоритетом для реформаторов федеральной бюрократии. Центр табачных изделий FDA умудряется сочетать практически полный провал регулирования с огромными затратами для регулируемых отраслей и для FDA.
До Англии дошли новости о назначении избранным президентом Трампом Элона Маска и Вивека Рамасвами в «Департамент эффективности правительства» (DOGE). Как мы понимаем, это будет неправительственная организация, которая будет консультировать Управление по управлению и бюджету (OMB — двигатель эффективности Белого дома) по вопросам реформ и эффективности, которые необходимо провести в федеральном правительстве. Может ли это принести какую-то пользу? Что касается регулирования табачных изделий Управлением по контролю за продуктами и лекарствами (FDA) через его Центр табачных изделий, то ответ на этот вопрос — однозначное «да».
Бюрократия, как известно, упорна и будет пытаться измотать реформаторов зарослями деталей, тупыми препятствиями и парадом «кровоточащих пней», предполагаемых жертв дерегулирования и сокращения штатов. Поэтому в целях ориентации в данной заметке приводится неполный обзор проблем регулирования табачных и никотиновых изделий Управлением по контролю за продуктами и лекарствами (FDA) и предлагаются эффективные реформы по каждому разделу.Я буду обновлять ее в ближайшие дни и недели; отзывы приветствуются.
Резюме: В регулировании табачной и никотиновой продукции необходимы значительные меры по повышению эффективности
Появление никотиновых продуктов с гораздо меньшими рисками, чем сигареты, открывает широкие возможности для снижения бремени смертности и болезней, вызванных курением. В США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов растрачивает эту возможность, создавая непреодолимые бюрократические барьеры для выхода на рынок почти всех ответственных производителей. Это привело к укреплению олигополии табачной промышленности, подавлению инновационных американских предприятий и позволило нелегальной продукции китайского производства доминировать на рынке, ущемляя интересы законопослушных производителей. Более 90 % вейп-продуктов, продаваемых в США, НЕ разрешены FDA, и рынок превратился в хаотичный беспорядок.
В условиях, когда подавляющее большинство рынка функционирует без разрешения, FDA не играет никакой значимой роли в защите общественного здоровья или общественных интересов, несмотря на то, что с 2009 года получает 8 миллиардов долларов в виде платы за пользование табачными изделиями. К счастью, американцы не ждут разрешения FDA, чтобы защитить свое здоровье за свой счет. Курение находится на рекордно низком уровне и почти исчезло среди молодежи. Несмотря на моральную панику в 2018-20 годах, количество вейперов среди молодежи сократилось на 72 % с момента пика в 2019 году.Снижение вреда от табака происходит вопреки FDA.
Тем не менее, полная либерализация рынка не будет оптимальной. Центр FDA по табачным изделиям (CTP) обладает достаточной гибкостью в рамках основополагающего Закона о борьбе против табака, чтобы радикально снизить барьеры для входа на рынок и сократить расходы на регулирование для себя и для заявителей. FDA не нуждается в дополнительных средствах; ему необходимо гораздо эффективнее использовать средства, выделенные Конгрессом, сосредоточиться на своей основной цели регулирования и отказаться от деятельности, выходящей за рамки его законного мандата.
Отсутствие общей согласованной стратегии регулирования
Оценка деятельности Центра табачных изделий при Управлении по контролю за продуктами и лекарствами США (FDA), проведенная Фондом Рейгана Удалла, выявила отсутствие согласованной стратегии регулирования (сквозная рекомендация 1) и произвольный подход FDA к стандарту общественного здравоохранения «целесообразно для защиты здоровья населения» (рекомендации 5c и 5d). Хотя FDA впоследствии опубликовало стратегию регулирования «Стратегический план CTP«, она в основном сосредоточена на общих чертах и далеко не соответствует требованию о создании целостной структуры для оценки и разрешения табачных и никотиновых изделий в интересах общества.Закон о контроле над табаком сохранил права на тысячи сигаретных изделий, и они остаются на рынке при относительно легком режиме обновления продукции (существенная эквивалентность). Сегодня на рынке законно продаются 3 816 различных сортов сигарет и 14 777 видов горючих продуктов [база данных FDA, доступ получен в ноябре 2024 года].
В отличие от этого, огромные барьеры для выхода на рынок стоят перед теми, кто выпускает продукцию с пониженным риском. Было разрешено всего восемь вейп-систем (34 продукта), в основном с одним вкусом (табачным) и двумя ментоловыми продуктами [см. текущий статус], и все от табачных компаний, выпускающих продукцию массового спроса. До сих пор не было разрешено ни одного кисета. На долю разрешенных вейп-продуктов приходится менее 10 % рынка, а остальные либо полностью нелегальны, либо находятся в двусмысленных правовых сумерках, поскольку они незаконны, но подлежат постоянному пересмотру, либо их запрет на маркетинг приостановлен судом. В отличие от этого, реестр Европейского союза содержит 300 000 разрешенных продуктов для вейпинга. Двадцать четыре ученых и эксперта, в основном проживающих в США, предложили FDA обновленную стратегию (см. the University of Michigan Tobacco Research Network – и full letter and briefing).

Предложение по реформе: сформулировать четкую, прозрачную стратегию выполнения обязанностей, возложенных на FDA/CTP Конгрессом, и сосредоточиться только на своих юридических обязанностях в соответствии с Законом о борьбе против табака.
Враждебность к инновациям
Конгресс разработал Закон о борьбе с табаком (TCA), чтобы поощрять инновации, полезные для здоровья (о чем говорится в докладе Института медицины 2001 года «Очищение от дыма: оценка научных основ снижения вреда табака«), но также и блокировать обманчивые инновации, такие как сигареты «Light» и «Mild», которые кажутся более безопасными, но содержат столько же смол, сколько и обычные сигареты. В отчете IoM за 2001 год содержатся прекрасные предложения по регулированию никотина в США, включающие 11 принципов (здесь — в обобщенном виде изложены мной здесь). Вполне разумно, что Конгресс ожидает от Управления по контролю за продуктами и лекарствами (FDA) отбора подлинных инноваций, способствующих снижению вреда здоровью, от вводящих в заблуждение мошеннических инноваций, и продвижения первых и блокирования вторых.
Но FDA делает все наоборот: например, одобрив сигареты 22nd Century с низким содержанием никотина, оно в то же время по якобы токсикологическим соображениям отклонило систему Juul и тысячи других никотиновых продуктов с низким уровнем риска, которые миллионы американцев используют в качестве альтернативы сигаретам (в настоящее время насчитывается 19 миллионов вейперов и около 30 миллионов курильщиков). FDA даже хвастается тем, что делает это [например, см. здесь, здесь, здесь], хотя это подвергает риску курильщиков и вейперов и разрушает вполне жизнеспособный бизнес, выступающий за здоровье.
Процесс подачи заявки настолько громоздкий и длительный, что американцы имеют доступ только к разрешенным продуктам, возраст которых приближается к десяти годам. Креативные научные, инженерные, маркетинговые и юридические возможности американских компаний расходуются на то, чтобы обосновать перед FDA продукты, которые уже устарели для потребителей, что дает серьезное преимущество ориентированным на потребителя инноваторам в Шэньчжэне, Китай, и тем самым поддерживает спрос на черном рынке.
Предложение по реформе: FDA должно продемонстрировать способность рассматривать и разрешать новые продукты в течение 180 дней (это уже является требованием раздела 910(c)(1)(a) TCA) и убедиться, что требования к процессу и режим оценки делают это осуществимым, чего в настоящее время не происходит.
Режим FDA подходит только для крупных игроков
Основными факторами, определяющими выдачу FDA разрешений на продажу вейпов, на сегодняшний день являются размер компании и однородность ее продукции, а не стандарт «целесообразно для охраны здоровья населения» (APPH). Многие небольшие компании выпускают продукцию, которая используется взрослыми в качестве альтернативы курению и соответствует стандарту APPH. Однако у этих компаний нет финансовых ресурсов или объемов продаж, чтобы доказать APPH в угоду FDA. Компании не раскрывают информацию о том, сколько средств они тратят на предварительные заявки на табачные изделия (PMTA). Тем не менее, из юридических документов (см. заявление Juul в FTC в параграфах 86-104) известно, что Juul потратила 100 миллионов долларов на свою первоначальную PMTA. PMTA обычно требуют многолетних усилий, десятков миллионов долларов и значительного опыта (также здесь).
Очень немногие компании и продукты имеют доходы, способные покрыть такие большие расходы на соблюдение требований. Используя этот фильтр по размеру и стоимости соответствия, FDA осуществляет агрессивное антиконкурентное удушение рынка, которое радикально сократит количество компаний и разнообразие продуктов, доступных на законных основаниях. Подход FDA также дает значительное преимущество табачным компаниям — они могут перекрестно субсидировать свои расходы на соответствие требованиям для массового рынка вейп-продукции за счет сильных балансов, построенных на прибыли от сигарет. Но если рынок вейпинга ослабнет, они будут продавать больше сигарет. Высокая стоимость — не единственный барьер для входа на рынок: неопределенность успеха и непрозрачные критерии успеха также добавляют значительный риск к затратам. Наконец, барьеры для входа стимулируют незаконную торговлю со стороны поставщиков, которые не понесли этих гигантских затрат на регулирование, что подрывает законные предприятия, стремящиеся к соблюдению требований.
Предложение по реформе: FDA должно сократить расходы заявителей на режим выдачи разрешений PMTA по меньшей мере на 80 % и обеспечить доступную ускоренную процедуру для малых и средних предприятий. Она должна стремиться к аналогичной экономии расходов на внутреннюю оценку.Затраты на подачу заявки должны быть сопоставимы с Европейским союзом.
Дико неточный анализ регулирующего воздействия
Обычно такие гигантские и искажающие вход барьеры выявляются в процессе нормотворчества, в том числе в ходе проверки OMB/OIRA. Сомнительно, что правило Deeming Rule 2016 года, в соответствии с которым вейпинг попал под юрисдикцию TCA и FDA, выдержало бы проверку, если бы вспомогательный анализ хотя бы приблизительно отражал реальное положение дел после его введения. В анализе регулирующего воздействия (RIA), проведенном FDA в 2016 году для своего правила о запрете, стоимость PMTA для электронных жидкостей составляет $131 643 (первая заявка) и $117 486 (последующие заявки) — см. таблицу 11b. FDA оценило среднюю стоимость PMTA для устройств в $466 563 (первая заявка) и $192 654 (последующие заявки) — см. таблицу 12b. Скорее всего, эти оценки занижены на два порядка. FDA также сильно недооценило количество заявок, которые оно получит. Управление получило 26 миллионов заявок PMTA на вейп-продукты, но по оценкам, сделанным в ходе исследования, речь шла о 4 050 электронных жидкостях и 747 устройствах ENDS — см. таблицу 7.
Предложение по реформе: FDA или надежная третья сторона должна повторить анализ регулирующего воздействия, но с цифрами, которые отражают реальность после внедрения.По результатам нового анализа OMB/OIRA должны определить, следовало ли продолжать действие правила 2016 года, и, с учетом возможности ретроспективного анализа, отменить его и заменить.
Непрозрачные критерии принятия решений
FDA не дало четкого ответа на вопрос о том, как оно будет разрешать или запрещать эти продукты, и эта неопределенность создает дополнительное бремя и повод для осторожности для вейп-компаний и их инвесторов. Руководство PMTA было неясным и запоздалым, стандарты или требуемые доказательства остаются неизвестными и меняются с течением времени без уведомления, а метод оценки APPH так и не был изложен. Такой подход к APPH в настоящее время является предметом обширного судебного разбирательства в соответствии с Законом об административных процедурах. Многие заявления, поданные способными вейп-компаниями среднего размера, убедительно свидетельствуют о произвольном и капризном поведении регулирующих органов.
Каким-то образом FDA разрешило сигарету (продукт 22nd Century VLN), но запретило гораздо более безопасный продукт Juul по токсикологическим соображениям. Если оно способно на такой экстремальный поступок, то это говорит о том, что оно может одобрить или запретить все, что пожелает. В тесте APPH учитывается целый ряд воздействий на поведение, возникающих при запуске нового продукта. Однако FDA никогда не описывало, как будет проводиться этот расчет и какой вес он будет придавать различным поведенческим изменениям. Например, какой вес следует придать предотвращению вейпинга у подростков по сравнению с тем, что заставит взрослых перейти от курения к вейпингу? FDA даже исключило подсчет некоторых выгод: например, молодых людей, переключившихся с курения на вейпинг. Нет никаких юридических или этических оснований для игнорирования таких преимуществ.
Предложение по реформе: FDA должно предоставить недвусмысленное руководство о том, как оно будет оценивать продукцию и соответствовать стандарту «целесообразно для защиты здоровья населения». Это должно включать ясность в отношении того, как оно будет находить компромиссы, оценивать несопоставимые преимущества и вред, а также учитывать долгосрочные последствия поведенческих изменений. В настоящее время этого не сделано.
Система авторизации ведет к чрезмерной осторожности и политизации
Система, требующая, чтобы регулятор разрешил продукт, будет склонна к чрезмерной, но асимметричной осторожности. Она будет чрезмерно подчеркивать возможные риски, связанные с одобрением, но недооценивать упущенные возможности, возникающие в случае отказа, поскольку они никогда не видны. Показатели мониторинга FDA свидетельствуют о том, что к 28 февраля 2023 года она отказалась принять 19,6 млн заявок PMTA, отказала в подаче 5,1 млн заявок и отклонила 1,3 млн заявок.
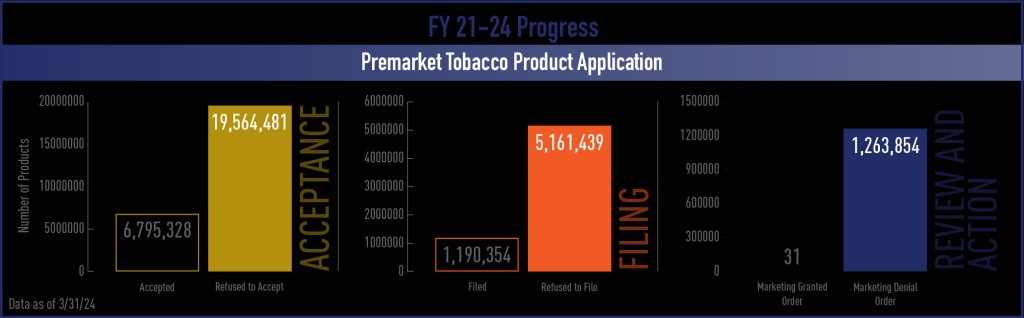
Однако FDA не имеет ни малейшего представления о совокупных последствиях таких действий, поскольку все они были отклонены по процедурным причинам, а не по существенным причинам, связанным с общественным здравоохранением. Ни один из этих продуктов не был признан непригодным для защиты здоровья населения. Однако все они были отклонены, потому что не смогли соответствовать чрезвычайно высокому, но нечеткому и подвижному стандарту FDA — доказать, что они подходят для защиты общественного здоровья по непрозрачным критериям. Разница имеет значение.
Кроме того, режимы выдачи разрешений широко открыты для политического вмешательства, поскольку активисты могут применять различные виды политического давления, чтобы добиться желаемого результата. Риск политизации особенно велик, когда процесс принятия решений непрозрачен (см. выше). В качестве примера можно привести конгрессмена Раджу Кришнамоорти, который утверждает, что он оказал влияние на комиссара FDA, чтобы добиться определенного результата или, как он выражается, «победы» (отказ Juul в выдаче PMTA).
Предложение по реформе: процесс должен стать как можно более «механистичным», основанным на прозрачном руководстве и стандартах, и как можно меньше оставлять непрозрачных и политически мотивированных решений. FDA должно подчинить свою собственную регуляторную практику стандарту «целесообразности для защиты здоровья населения», чтобы убедить Конгресс в том, что его интерпретация закона не приносит больше вреда, чем пользы, и не нарушает его цели.
FDA придерживается упрощенного взгляда на рискованное поведение молодежи
Почти все взрослые согласны с тем, что молодые люди не должны вейпить, курить, принимать наркотики, водить машину в нетрезвом состоянии, вступать в банды, заниматься сексом преждевременно и т. д. Но это всего лишь предпочтения взрослых. Они не являются основой для выработки политики, поскольку мы знаем, что часть молодых людей участвует в рискованном поведении, нравится нам это или нет. Поэтому регулирующие органы должны учитывать вредные непредвиденные последствия своих действий и стараться снизить реальные риски для молодежи. Ряд исследований свидетельствует о том, что курение и вейпинг являются заменителями, что вейпинг вытесняет курение для некоторых молодых людей и что наиболее интенсивно вейпят те подростки, которые в противном случае курили бы. Меры по предотвращению вейпинга могут привести к росту курения, нелегальной торговли или поощрению обходных путей.
Недостаточно просто отрицать важность этих эффектов, если это приводит к непредвиденным негативным последствиям. Кроме того, невозможно просто разделить интересы подростков и взрослых в их жизни: подростки испытывают вред от курения через ролевое влияние родителей, потерю семейного дохода, болезнь и смерть родителей, а также воздействие пассивного курения. FDA не признает последствий этого для здоровья населения. Заявители на получение разрешения PMTA не могут предоставить конкретные доказательства таких последствий для продукта, даже если они имеют существенные последствия для здоровья населения.
Более полный анализ с источниками см. в моем брифинге о вейпинге для молодежи.
Предложение по реформе: FDA должно использовать меру воздействия на здоровье, такую как дисконтированные годы жизни с поправкой на качество, для определения своего подхода к компромиссу между императивом здоровья, связанным с отказом от курения для взрослых, и беспокойством по поводу распространения вейпинга среди молодежи. FDA также должно включить в свой подход контрфактический анализ, чтобы учесть случаи курения вейпов среди молодых людей, которые в противном случае курили бы. Если бы Управление предприняло эти шаги, оно бы полностью сосредоточилось на сокращении курения среди взрослых и молодых людей, которые в противном случае курили бы.
FDA избегает ответственности за совокупный эффект миллионов решений
На данный момент FDA разрешило лишь небольшое количество продуктов для вейпинга; все они, за исключением одной системы, имеют табачный вкус и в общей сложности составляют менее 10% от всего отслеживаемого рынка. В 2018 году FDA опубликовало предварительное уведомление о предлагаемых правилах, сигнализирующее о намерении запретить все или большинство ароматизированных электронных жидкостей, кроме табачных и, возможно, некоторых ментоловых вкусов. В соответствии с разделом 907 TCA, такое законотворчество (стандарт на табачные изделия) возлагает бремя демонстрации APPH на FDA. Агентству будет крайне сложно справиться с этим бременем, поскольку ему придется оценить последствия сокращения рынка вейпов до нескольких продуктов, не используемых большинством взрослых вейперов, и закрытия всех небольших вейп-шопов, которые оказывают поддержку в борьбе с курением на уровне сообщества. Необходимо будет учесть незаконную торговлю, ароматизаторы «сделай сам» и многочисленные возможные обходные пути. Также необходимо учесть вероятность того, что многие подростки, которые сейчас вейпят, вернутся к курению.
Не так уж и велик был бы рост курения, чтобы полностью перечеркнуть все надежды на пользу от сокращения количества вейпов среди молодежи. Поэтому FDA и не пыталось этого сделать. Вместо этого оно разработало такие ограничительные критерии для разрешения вкусов на уровне индивидуальных заявок на продукцию (PMTA), что чистый совокупный эффект почти не изменился.Хотя FDA недавно разрешило один сорт со вкусом ментола, это было оправдано использованием стандарта, которому могли соответствовать немногие другие компании. Возможно, это была тактическая уступка, направленная на защиту FDA в спорном судебном процессе, а не открытие жизнеспособного пути на рынок для ароматизированных продуктов.
Приведенный выше пример иллюстрирует общую проблему. Ни один заявитель не может доказать, что отказ от их конкретного продукта будет иметь существенные последствия для всего рынка (например, закроет все вейп-магазины или вызовет массовый возврат к курению среди вейперов), потому что один продукт не будет иметь такого эффекта, когда есть другие, на которые можно перейти. Однако, когда все продукты определенного типа запрещены, могут возникнуть значительные негативные последствия для всего рынка, за которые никто в FDA, похоже, не отвечает или даже не заинтересован в их понимании.
Предложение по реформе: FDA должно рассматривать свою роль в масштабах всей системы, поскольку именно она, а не отдельные продукты, влияет на американскую общественность. Это означает рассмотрение совокупного воздействия, возникающего в результате отклонения тысяч аналогичных заявок, при котором ни один из этих вопросов не может быть рассмотрен на уровне отдельного продукта. Если бы FDA придерживалось такого подхода, оно бы с гораздо большей неохотой предоставляло такие регулятивные меры защиты торговле сигаретами и такие щедрые преимущества китайскому нелегальному рынку. Оно бы больше ценило инновационную американскую промышленность, выступающую за здоровье и предлагающую гораздо более безопасную альтернативу сигаретам.
Скрытое нормотворчество
Не издавая правила и не проходя через процесс нормотворчества, FDA может навязать стандарты де-факто, используя общую практику для тысяч приложений. Используя процесс PMTA как форму скрытого нормотворчества, FDA не нужно оценивать или обосновывать совокупное влияние миллионов отдельных решений, каждое из которых обосновывается без ссылки на другое. Однако, поскольку FDA применяет одни и те же ограничительные критерии к каждому продукту, будут иметь место негативные последствия для всего рынка, за оценку которых никто не отвечает. Однако, используя процесс PMTA, а не нормотворчество, FDA избегает необходимости оценивать и обосновывать эти совокупные последствия.Это потенциально незаконное фактическое нормотворчество уже стало предметом судебного разбирательства, и Пятый окружной апелляционный суд занял скептическую позицию (см. дело «Рейнольдс против FDA» — см. A.3 на стр. 11).Тот факт, что Управление разрешило одну вейп-систему со вкусом ментола, не отменяет опасений, что на практике оно действует как фактический запрет.
Предложение по реформе: FDA должно обосновывать свои действия как «необходимые для защиты общественного здоровья», независимо от того, делает ли оно это в целях разработки правил.
Фатально неверные представления о рисках
Широкая общественность, потребители, средства массовой информации, медицинские работники, регулирующие органы и политики в той или иной степени основывают свои суждения и решения на своем понимании рисков — например, относительных рисков вейпинга по сравнению с курением, бездымного табака по сравнению с сигаретами, а также того, вреден ли никотин или вызывает привыкание. Исследование HINTS, проведенное Национальным институтом рака, показывает, что эти представления о рисках сильно расходятся со здравым научным пониманием. Например, в исследовании HINTS 2022 только 1,6% правильно ответили, что вейпинг гораздо менее опасен, чем курение. Однако 50 % считали его таким же или более вредным, а 37,5 % не знали, что и думать. По данным HINTS 2017, 71 % не знали, что бездымный табак менее опасен, чем сигареты. HINTS 2019 обнаружил, что большинство людей (56 %) ошибочно полагают, что никотин — это вещество, вызывающее большинство видов рака, связанных с курением, и еще 19 % не знают. Разумеется, FDA не несет единоличной ответственности за эти ошибочные представления. Большое влияние оказывают CDC и многочисленные источники и движущие силы новостного потока. Однако FDA/CTP ежегодно тратит 125 миллионов долларов на просветительские кампании и 17 миллионов долларов на коммуникации (2023 год, отчет Конгрессу). Из всех этих расходов на коммуникацию лишь малая часть направлена на устранение неверных представлений о рисках, а большая часть преувеличивает риски или усиливает неверные представления о них. Собственные усилия FDA по информированию о рисках совершенно неадекватны и вряд ли улучшат восприятие рисков общественностью. См. раздел «Смертельное недопонимание»: FDA не в состоянии объяснить относительные риски табачных изделий. Несмотря на то, что FDA несет ответственность с 2016 года, в 2024 году оно заказало исследование по информированию о рисках, которое займет годы и вряд ли приведет к требуемой откровенности: например, сравните это публичное сообщение Национальной службы здравоохранения Великобритании:

Программа реформ: FDA и CDC должны согласовать пакет информативных и действенных сообщений о рисках, связанных с негорючими никотиновыми продуктами и самим никотином. Агентства должны прилагать все усилия для борьбы с дезинформацией, которую в некоторых случаях они продвигали, например, с ложными опасениями по поводу EVALI, эффекта шлюза, попкорнового легкого и т.д. CDC должно быть ведущим агентством по информированию о рисках. FDA — это регулятор, который должен осуществлять регулирование с учетом риска.
Научная программа, чрезмерно ориентированная на поиск проблем и ограничительное регулирование
Научная деятельность, финансируемая FDA, представляет собой более обширную тему, чем можно рассмотреть здесь. Большая часть научных исследований, поддерживаемых за счет пользовательских сборов, выплачиваемых FDA и направляемых через NIH, не способствует соразмерному регулированию или реалистичному восприятию рисков. В них часто преувеличиваются риски, утверждаются надуманные причинно-следственные связи, такие как эффект «шлюза», и преуменьшаются или игнорируются возможности общественного здравоохранения. Бюджет FDA на научные исследования (включая Управление по науке в FDA) составляет 305 миллионов долларов (2023 год, отчет Конгрессу). Структуры стимулирования исследований и институциональная культура, вероятно, лежат в основе искажений в науке, возникающих из-за того, что регулятор является доминирующим финансистом науки.Финансирование науки должно быть полностью под контролем агентств, финансирующих исследования, и они должны определять приоритеты финансирования на основе научной и общественной ценности. Направление средств на исследования через FDA является искажающим и расточительным, что приводит к сотням исследований с сомнительными научными достоинствами и негласному конфликту интересов. У FDA есть внутренняя потребность в научном потенциале, и его научное финансирование должно быть направлено только на удовлетворение этой потребности из внутренних или внешних источников.
Предложение по реформе: Бюджет FDA на научные исследования в области табака должен быть ограничен теми средствами, которые необходимы для выполнения его юридических обязанностей. Другие научные исследования в области табака и никотина должны быть обоснованы и финансироваться из бюджета NIH или других организаций, финансирующих исследования. Необходимо провести независимый анализ качества научных исследований в области табака и никотина, финансируемых FDA/NIH, и прекратить финансирование центров, занимающихся некачественными или неактуальными научными исследованиями.
Контрпродуктивное применение неработающего режима регулирования
Было много призывов к активному и агрессивному правоприменению. Однако следует проявлять осторожность, поскольку режим выдачи разрешений работает так плохо, и большинство продуктов на рынке в настоящее время технически незаконны. Последствия дезорганизации, вызванной широкомасштабным правоприменением, не были оценены и, скорее всего, нанесут огромный ущерб здоровью населения. В ближайшей перспективе необходимо тщательно определить приоритеты правоприменения, сосредоточившись на криминальных сетях и продуктах, на которые никогда не подавались заявки PMTA. По мере того как режим выдачи разрешений будет становиться все более рациональным и пропорциональным, имеет смысл в конечном итоге усилить правоприменение, чтобы охватить всю продукцию, не соответствующую требованиям.
Важнейшей стратегией правоприменения является радикальное сокращение объема незаконной деятельности путем авторизации нескольких тысяч вейп-продуктов и пакетиков, что возможно только при радикальном снижении барьеров для входа. Напомним, что сегодня на рынке легально продается 3 816 вариантов сигарет, так что призыв разрешить несколько тысяч вейпов не является чем-то необычным.
Предложение по реформе: FDA должно в приоритетном порядке провести масштабную работу по упрощению процесса PMTA и разрешить несколько сотен или тысяч продуктов с пониженным риском. В то же время правоохранительная деятельность должна быть направлена на борьбу с возникающими преступными сетями, которые FDA непреднамеренно взрастило своими регулятивными нагрузками.
Нет никаких оснований для повышения пользовательских сборов
Как и все бюрократические структуры, FDA любит деньги — чем больше, тем лучше, и FDA выступает за дополнительное финансирование в размере 114 миллионов долларов в год, начиная с 2025 года. В соответствии с разделом 919 TCA, FDA получило чуть более 8 миллиардов долларов США в качестве платы за пользование табачными изделиями с момента передачи ему юрисдикции в соответствии с TCA в 2009 году и в настоящее время получает 712 миллионов долларов США в год. Этого должно быть достаточно. Значительная часть бюджета Управления расходуется нерационально и не на выполнение основных регуляторных функций — например, Управление тратит значительные средства на просвещение населения и финансирует научные исследования сверх того, что необходимо для выполнения его регуляторных функций. Значительная часть бюджета на основные регуляторные функции расходуется на решение проблемы, которую FDA создало само: удивительно дорогой процесс вывода на рынок новых никотиновых продуктов — он обременителен как для заявителей, так и для собственных экспертов FDA. Упрощение процесса позволило бы сократить расходы и повысить эффективность для обеих сторон.
Есть основания для более тщательного анализа того, как FDA расходует свои деньги, и почему так мало было достигнуто за 8 миллиардов долларов США, потраченных с 2009 года. Нет никаких оснований для их увеличения.Возможно, есть смысл перераспределить бремя оплаты услуг пользователей, чтобы все продукты, разрешенные FDA, платили и несли соответствующую долю. На фоне этого огромные асимметричные затраты на соблюдение требований, с которыми сталкиваются продавцы вейпов или нагреваемых табачных изделий, вынужденные идти по пути PMTA, а не по пути дедовщины и существенной эквивалентности, которые делают появление сигарет на рынке дешевым и легким.
Предложение по реформе: Бюджет FDA должен значительно сократиться за счет ликвидации расходов на деятельность, выходящую за рамки его законных полномочий и мандата Конгресса (в частности, на просвещение населения, что является задачей CDC, и на науку, которая должна быть приоритетной и финансироваться через органы, финансирующие исследования). Дополнительную экономию можно получить за счет значительного упрощения процесса PMTA, поскольку это снизит затраты как заявителей, так и стоимость оценки FDA. Расходы на приведение окладов сотрудников ЦТП в соответствие с (более высокой) нормой агентства должны быть покрыты за счет экономии средств, как описано выше, и сокращения численности персонала с учетом уменьшения потребности.
Упрощение процесса возможно и необходимо
Основным барьером на пути прогресса в области снижения вреда от табака является требование, чтобы табачные и никотиновые изделия с пониженным риском проходили процедуру предпродажного тестирования (PMTA) в соответствии с разделом 910 Закона о табаке. Точнее говоря, препятствие на пути к выходу на рынок создается дорогостоящей интерпретацией FDA требований этого раздела Закона, которая выходит далеко за рамки того, что написано Конгрессом в самом законе. Радикальное упрощение в соответствии с принципами, изложенными в Законе, позволило бы:
- Продукт. Предпродажная оценка будет ограничена характеристиками самого продукта. Это включает в себя соблюдение рекомендаций по химической, электрической и термической безопасности, а также обеспечение ответственного подхода к упаковке и маркетингу, не ориентированного на молодежь.Это единственный способ уложиться в 180-дневный срок, установленный Конгрессом для завершения процесса оценки.
- Совершенствование продукции. Быстрый и эффективный процесс необходим для разрешения усовершенствований продукции, особенно если они улучшают здоровье и безопасность или помогают бросить курить.
- Производство. Может включать стандарты GMP для производителей и импортеров.
- Надзор. Вместо того чтобы включать обязательства по надзору в разрешения на отдельные продукты, что является одновременно неполным и расточительно дублирующим, FDA должно проводить надзор за всем рынком, включая незаконную торговлю и несанкционированные продукты. Это должно стать основой для корректирующих действий и правоприменительной деятельности после выхода продукции на рынок.
- Популяционные эффекты. Любое неблагоприятное воздействие на популяцию должно быть выявлено в ходе постмаркетингового наблюдения и подлежать корректирующим действиям, включая отзыв и отмену разрешения.
- Информирование о рисках. FDA и CDC должны предоставить ряд «выводов» об абсолютных и относительных рисках никотина и табачных изделий. Это должны быть простые, действенные, правдивые заявления, адресованные потребителям, медицинским работникам, СМИ, политикам и промышленникам.
- Правоприменение. Проблема незаконной торговли должна решаться в первую очередь путем вытеснения нелегальной торговли законными продуктами и поставщиками (т. е. сотнями или тысячами других разрешенных продуктов). До сих пор правоприменение не было успешным в масштабах всего рынка.Интенсивный регуляторный контроль FDA не распространяется на >90% продуктов, используемых 19 миллионами американцев.
Долгосрочная нормативная база
В долгосрочной перспективе FDA нуждается в новом законодательстве, которое не будет строиться на концепции «необходимого для защиты общественного здоровья». Никотиновые продукты являются психоактивными веществами, предназначенными для отдыха, и не предназначены для защиты здоровья населения. Никто не стал бы регулировать таким образом, скажем, пиво. Однако пиво регулируется многими способами, которые были бы уместны для регулирования никотина: ингредиенты, химическое качество, микробиология, процесс производства, возрастные ограничения, упаковка и маркировка, маркетинговый контроль, налогообложение и т. д. Цель состоит в том, чтобы сделать продукты, которые широко используются, доступными с допустимыми рисками и соответствующим контролем.
Предложение по реформе: OMB или другой подходящей организации следует поручить проведение исследований по будущему эффективному и рациональному регулированию потребительских никотиновых продуктов с тем, чтобы исполнительная власть представила законопроект на рассмотрение Конгресса.



