Цитотоксичность, мутагенность и генотоксичность аэрозолей выхлопа электронных сигарет по сравнению с сигаретным дымом: проект REPLICA
Источник: Scientific Reports
Перевод публикуется с минимальной прередакцией
- Rosalia Emma,
- Virginia Fuochi,
- Alfio Distefano,
- Konstantinos Partsinevelos,
- Sonja Rust,
- Fahad Zadjali,
- Mohammed Al Tobi,
- Razan Zadjali,
- Zaina Alharthi,
- Roberta Pulvirenti,
- Pio Maria Furneri,
- Riccardo Polosa,
- Ang Sun,
- Massimo Caruso,
- Giovanni Li Volti &
- the Replica Project Group
Аннотация
В последнее время все чаще высказываются опасения, что добросовестность некоторых научных исследований вызывает сомнения из-за невозможности воспроизвести заявленные результаты некоторых экспериментов и тем самым подтвердить обоснованность выводов исследователя. Это явление получило название «кризис воспроизводимости» и затрагивает различные области — от медицины до фундаментальных прикладных наук. В связи с этим проект REPLICA направлен на воспроизведение ранее проведенных in vitro исследований токсичности сигаретного дыма и аэрозоля электронных сигарет, при необходимости добавляя эксперименты или условия, с целью проверки надежности и воспроизводимости данных. В данной работе группа REPLICA воспроизвела биологическую и токсикологическую оценку, опубликованную Раддом и коллегами в 2020 году. Как и в оригинальной работе, мы провели анализ поглощения нейтрального красного (NRU) для оценки цитотоксичности, тест Эймса для оценки мутагенеза и анализ микроядер In Vitro (IVMN) для оценки генотоксичности на клетках, обработанных сигаретным дымом или аэрозолем электронных сигарет. Результаты показали высокую цитотоксичность, мутагенность и генотоксичность, индуцированные сигаретным дымом, и незначительный или нулевой цитотоксический, мутагенный и генотоксический эффекты, индуцированные аэрозолем электронных сигарет. Хотя эти два исследования имели некоторые методологические различия, полученные результаты подтвердили данные, представленные ранее Раддом и коллегами.
Введение
В последние годы растет интерес к электронным сигаретам (ЭС) как к потенциально более безопасной альтернативе традиционным табачным изделиям. По результатам анализа безопасности, проведенного Комитетом по токсичности химических веществ в продуктах питания, потребительских товарах и окружающей среде (COT), было сделано заключение, что при правильном изготовлении и использовании электронных сигарет риск возникновения негативных последствий для здоровья значительно ниже по сравнению с горючими табачными сигаретами. Однако остается неопределенность в отношении потенциального риска для здоровья, связанного с вдыханием ароматизаторов и термически обработанных продуктов из электронных сигарет[1].
Озабоченность общественным здравоохранением и регуляторной политикой, связанной с токсикологическими аспектами паровых продуктов, привлекла внимание всего мира. В первую очередь это было вызвано сообщениями о случаях поражения легких (так называемых EVALI), связанных с неправильным использованием электронных сигарет для потребления тетрагидроканнабинола (ТГК) и применением добавок витамина Е[2]. В ряде стран, включая Индию, Австралию, Оман, Египет, Колумбию и другие, электронные сигареты запрещены, в то время как в других странах введено регулирование маркетинга электронных сигарет и электронных жидкостей. Такие регулирующие органы, как Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) и Европейский союз (ЕС), выпустили требования и рекомендации по регулированию предпродажных заявок на табачные изделия для электронных систем доставки никотина[3],[4].
Для оценки токсикологического потенциала электронных сигарет международные руководства, такие как Международная конференция по гармонизации S2(R1) (2011), Комитет по мутагенности химических веществ в продуктах питания, потребительских товарах и окружающей среде Великобритании (2011), Министерство здравоохранения Канады (2005) и Центр сотрудничества по научным исследованиям в отношении табака (CORESTA) (2004), рекомендуют использовать комплекс тестов in vitro в рамках стратегии доклинической оценки. Эти рекомендации предусматривают оценку различных конечных токсикологических точек с помощью нескольких тестов, включая бактериальный тест обратной мутации (Эймса) для определения мутагенности, микроядерный тест in vitro (IVMN) для определения генотоксичности и тест поглощения нейтрального красного цвета (NRU) для оценки острой цитотоксичности[5],[6],[7]. Эти три теста токсичности in vitro обычно используются в качестве стандартных для оценки токсичности табачных изделий и электронных сигарет[8].
Крупнейшие производители электронных сигарет опубликовали исследования, посвященные оценке их продукции, включая данные о выбросах, цитотоксичности, генотоксичности и мутагенности[9],[10],[11],[12]. Независимое повторение этих исследований имеет решающее значение для проверки результатов и установления достоверности данных, что поддерживает регулирование электронных сигарет. Неверные или ошибочные результаты могут дезинформировать политику и оказать пагубное влияние на исследовательскую практику, подорвать доверие общества к науке и, в конечном итоге, повлиять на практику здравоохранения и социального обслуживания. Для решения этой проблемы был инициирован многоцентровый проект REPLICA, направленный на воспроизведение резонансных исследований, проведенных научно-исследовательскими подразделениями табачных компаний, с целью оценки достоверности оригинальной работы, подвергнутой тщательной проверке (https://replica.coehar.org/).
На заключительном этапе проекта REPLICA итальянская команда (CoEHAR, Университет Катании — лаборатория А) и их партнер из Омана (Университет Султана Кабуса — лаборатория В) провели исследование по повторению статьи, опубликованной Раддом и коллегами из Imperial Brands PLC[9]. В этой работе приводится сводка сравнительных данных по аэрозольным выбросам и токсичности in vitro с использованием методов поглощения нейтрального красного (NRU), бактериальной обратной мутации (Ames) и микроядерного анализа in vitro (IVMN). В исследовании использовалась электронная сигарета с капсульной системой (myblu; Imperial Brands PLC, Бристоль, Великобритания) в сравнении с эталонной горючей сигаретой 3R4F (Университет Кентукки). Исследователи отметили, что многие вредные и потенциально вредные компоненты, присутствующие в дыме горючих сигарет, не были обнаружены в аэрозоле электронных сигарет. По результатам биологических тестов in vitro аэрозоль электронных сигарет не проявлял мутагенной или генотоксической активности в заданных условиях. Напротив, сигаретный дым 3R4F проявил мутагенную и генотоксическую активность. Кроме того, аэрозоль электронной сигареты оказался в 300 раз менее цитотоксичным, чем дым горючих сигарет, по результатам анализа поглощения нейтрального красного.
В данном исследовании мы повторили биологические тесты in vitro для изучения цитотоксической, мутагенной и генотоксической активности аэрозоля электронных сигарет myblu по сравнению с дымом горючих сигарет 1R6F (Университет Кентукки). Для оценки и подтверждения полученных результатов мы использовали методы, аналогичные тем, которые применяли Радд и коллеги[9].
Результаты
Цитотоксичность: влияние дыма сигарет и аэрозоля myblu на жизнеспособность клеток.
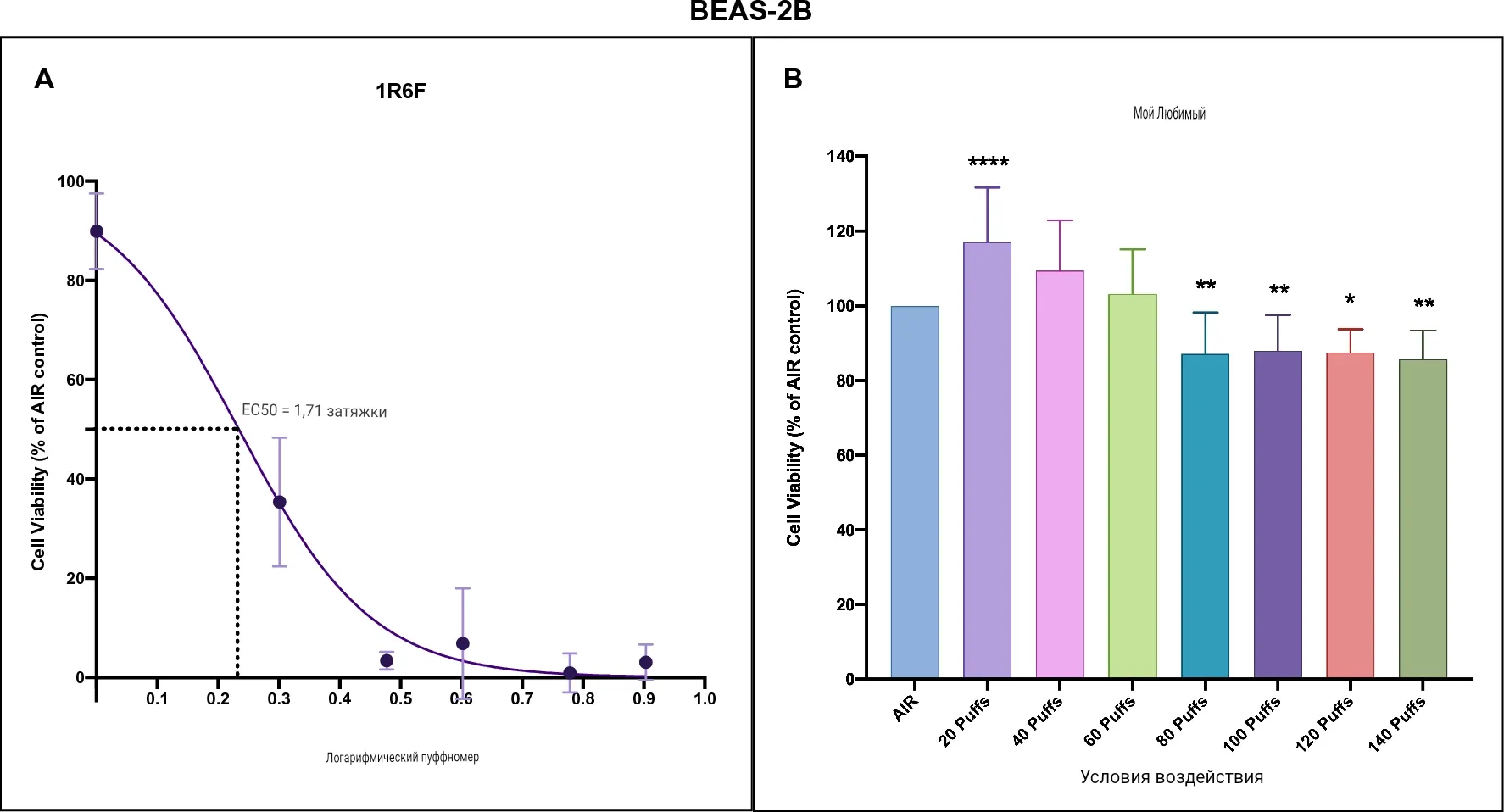
После воздействия дыма от эталонных сигарет 1R6F жизнеспособность клеток BEAS-2B резко снижалась уже на 2 затяжке до полной гибели клеток на 4 затяжке при значении EC50 1,71 затяжки (рис. 1А). В отличие от Rudd и коллег, для воздействия myblu значение EC50 рассчитать не удалось из-за низкой цитотоксичности при 140 затяжках (рис. 1В). Мы наблюдали снижение жизнеспособности клеток, начиная с 80-140 затяжек, которое не опускалось ниже 80% жизнеспособности. В частности, значительное снижение жизнеспособности клеток наблюдалось при 80 (P = 0,003), 100 (P = 0,008), 120 (P = 0,038) и 140 затяжках (P = 0,004) по сравнению с контролем AIR.
Рисунок 1
В дополнение к работе Радда и коллег мы микроскопически наблюдали клетки, подвергшиеся воздействию дыма 1R6F и аэрозоля миблу через 24, 48 и 65 ч. Воздействие дыма 1R6F на клетки BEAS-2B вызывало морфологические изменения клеток с изменением объема клеток, объема ядра и сферичности клеток во всех временных точках (рис. S1 дополнительного материала). Аналогичные морфологические изменения клеток BEAS-2B наблюдались и после воздействия аэрозоля myblu, начиная с 80 затяжек в течение 24 ч. Однако с 48 ч наблюдалось обратное развитие морфологических изменений до полного восстановления в течение 65 ч (рис. S2 дополнительного материала).
Эффект мутагенности сигаретного дыма 1R6F и аэрозоля myblu
Показатели отрицательных контролей (контроль растворителя) находились в пределах нормы, исходя из опыта нашей лаборатории и литературных данных3. Положительные контроли (химический контроль, азид натрия, дауномицин и 2-аминоантрацен) также находились в диапазоне, указанном в инструкции по производству (Trinova Biochem GmbH-Germany). Значимых различий между контролем растворителя и контролем AIR для всех тестируемых условий не наблюдалось. Напротив, значительные различия наблюдались между контрольными образцами растворителя или AIR и соответствующими химическими контрольными образцами (P < 0,0001).
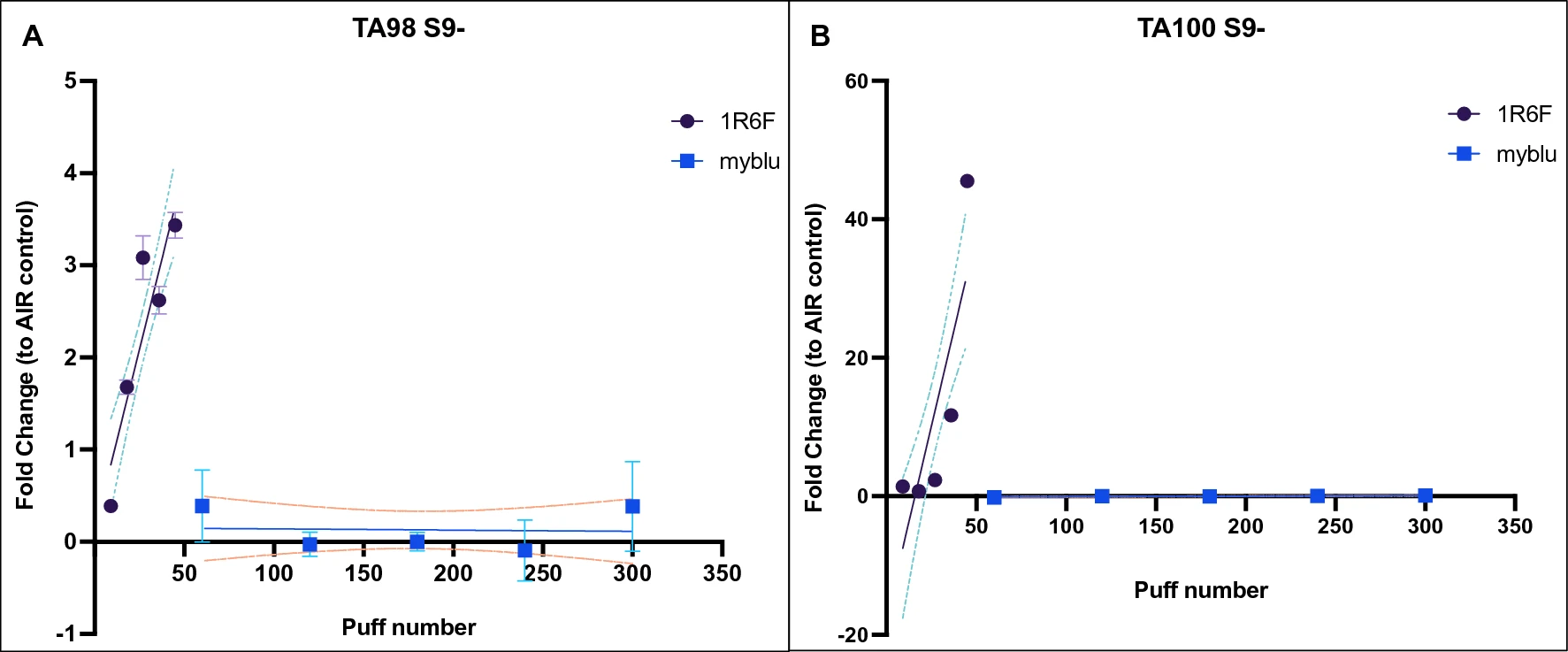
Воздействие горючего сигаретного дыма 1R6F вызывало значительное увеличение количества ревертантов в дозозависимой манере без активации метаболизма S9. Действительно, значительное дозозависимое увеличение количества ревертантов наблюдалось как в TA98 (примерно в 3,5 раза по сравнению с контролем AIR; P < 0,0001), так и в TA100 (до 45 раз по сравнению с контролем AIR; P < 0,0001) без активации метаболизма S9 после воздействия сигаретного дыма 1R6F. Воздействие аэрозоля myblu не вызывало значительного увеличения числа ревертантов у обоих штаммов (рис. 2). Результаты линейной регрессии мутагенной активности в Salmonella typhimurium (TA98 и TA100) без активации метаболизма S9 приведены в табл. S2 (дополнительный материал).
Рисунок 2
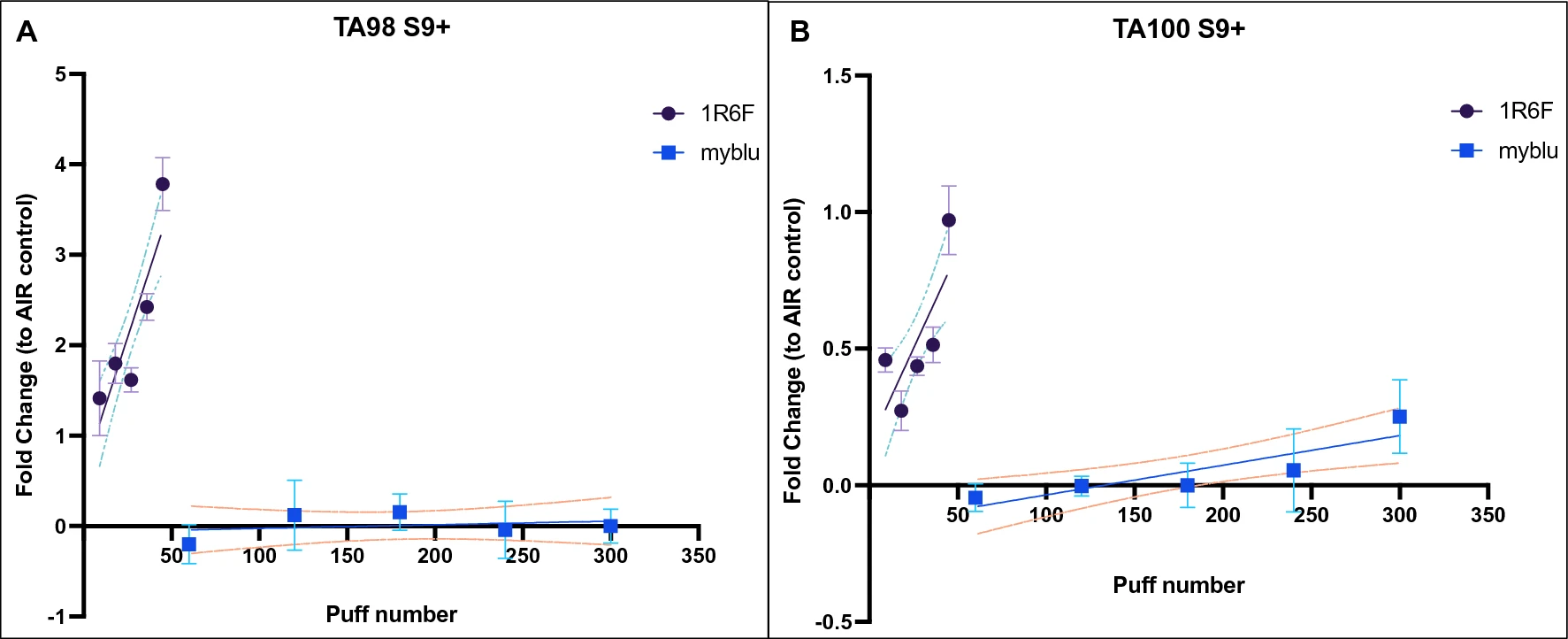
Аналогичные результаты были получены при проведении анализа Эймса как для TA98 (почти четырехкратное изменение по сравнению с контролем AIR; P < 0,0001), так и для TA100 (однократное изменение по сравнению с контролем AIR; P = 0,002) с активацией метаболизма S9. Для штамма TA98 с активацией метаболизма S9 после воздействия аэрозоля миблу не наблюдалось значительного увеличения количества ревертантов (линейный наклон не отличался от нуля; P = 0,91). Напротив, для TA100 S9+ после воздействия аэрозоля миблу наблюдалось незначительное увеличение количества ревертантов (примерно до 0,2-кратного изменения по отношению к контролю AIR), причем линейный наклон значительно отличался от нуля (P = 0,005) (рис. 3). Результаты линейной регрессии мутагенной активности в Salmonella typhimurium (TA98 и TA100) с активацией метаболизма S9 приведены в табл. S1 (дополнительный материал).
Рисунок 3
Генотоксическое действие дыма сигарет 1R6F и аэрозоля myblu
В связи с тем, что система воздействия отличается, и мы не смогли провести разбавление дыма, мы провели кривую доза-ответ для определения дозы EC50 для клеток V79, подвергшихся воздействию дыма 1R6F горючих сигарет целиком: рассчитанное значение EC50 для клеток V79 составило 3,149 затяжки (рис. S3 дополнительного материала). Затем мы провели анализ IVMN с активацией и без активации метаболизма S9 после воздействия от 1 до 4 затяжек дыма горючих сигарет 1R6F. Для воздействия myblu использовались те же цифры затяжек, что и в Rudd et al. (2020) (20-100 затяжек).
Не было показано различий между тремя отрицательными контролями — клетками, оставленными расти в инкубаторе погруженными в культуральную среду (INC), клетками, оставленными расти в инкубаторе с апикальной стороной, открытой воздуху в режиме взаимодействия воздух-жидкость (ALI), и клетками, подвергнутыми воздействию затяжек лабораторного воздуха, отфильтрованного от твердых частиц с помощью Кембриджского фильтрующего устройства (AIR), как для IVMN с активацией S9, так и без нее. Напротив, положительные контроли, включая циклофосфамид А (для IVMN S9+) и митомицин С (для IVMN S9-), были значительно увеличены по сравнению с соответствующими контролями AIR (Cyclo A P < 0,0001; Mito C P = 0,002).
Результаты анализа IVMN без S9 (S9-) представлены на рис. 4. Частота микроядер для воздействия 1R6F не показала дозозависимого увеличения вследствие высокой цитотоксичности (табл. S5 дополнительного материала) неразбавленного дыма (рис. 4A). Однако все номера затяжек 1R6F (от 1 до 4) вызывали значительное увеличение частоты микроядер (P < 0,0001) по сравнению с контролем AIR (рис. 4В). Напротив, после воздействия аэрозоля myblu до 100 затяжек существенного увеличения частоты микроядер не наблюдалось (рис. 5В и табл. S6 дополнительного материала).
Рисунок 4
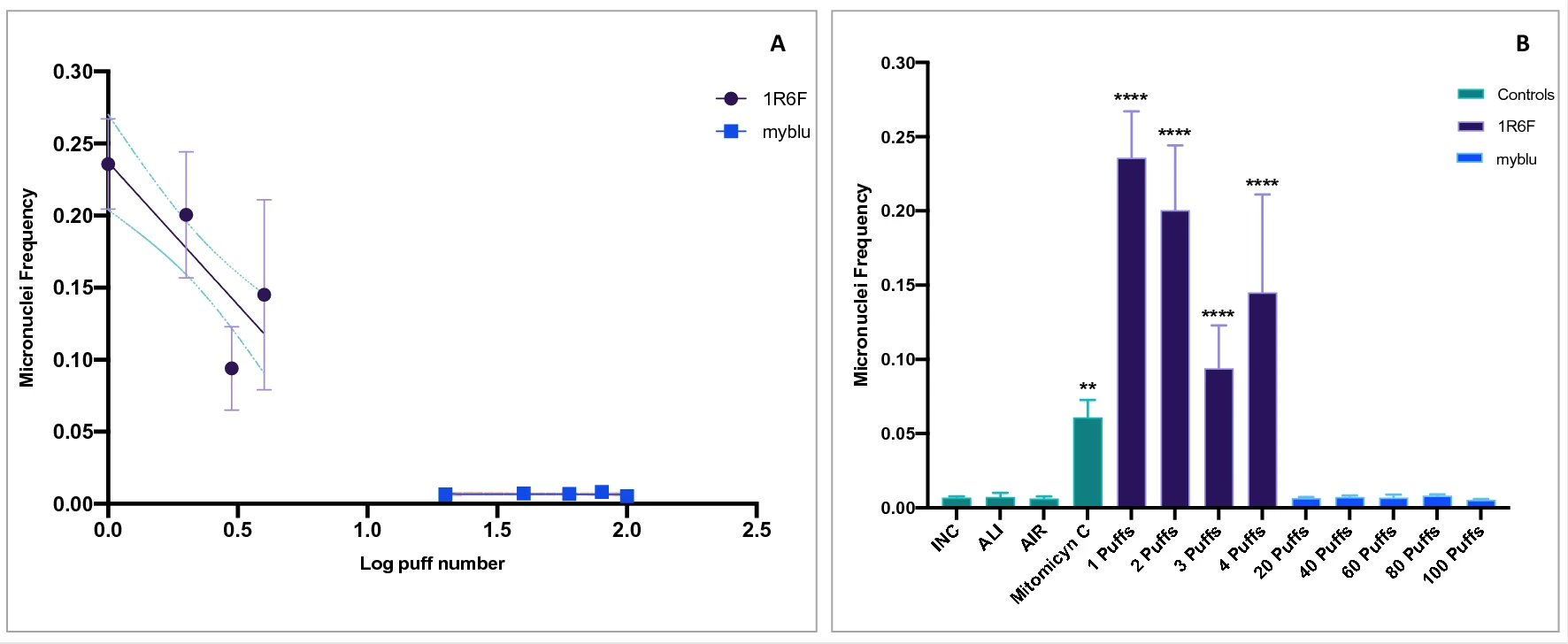
Рисунок 5
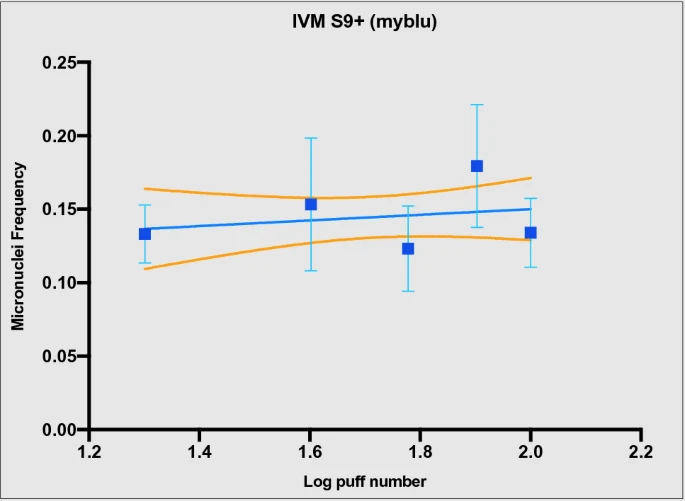
При проведении анализа IVMN с активацией метаболизма S9 высокая цитотоксичность наблюдалась для 1R6F, меньшая — для myblu (см. табл. S3 и S4 дополнительного материала). Особенно выраженная цитотоксичность наблюдалась для клеток V79, подвергшихся воздействию горючего сигаретного дыма, вплоть до невозможности проведения подсчета микроядер. Причиной такой цитотоксичности была названа смесь S9, которая, как известно, обладает цитотоксичностью4 (см. рис. S4 дополнительного материала). Особенно в случае анализа IVMN с S9 из 1R6F цитотоксическое действие смеси S9 и неразбавленного дыма сигарет суммировалось, что делало анализ нецелесообразным. Однако, несмотря на цитотоксичность S9, мы смогли провести количественное определение микроядер, чтобы завершить IVMN-анализ для myblu. Наклон регрессии не отличался от нуля (P = 0,5) (рис. 5), а все частоты микроядер, соответствующие каждому числу затяжек myblu, не отличались от контроля AIR.
В связи с высокой цитотоксичностью смеси S9 и тем, что в руководстве OECD n. 487 указано, что анализ IVMN может проводиться как с активацией S9, так и без нее, мы провели этот анализ без смеси S9 в дополнение к тому, что было сделано Раддом и коллегами.
Обсуждение
В последние годы проблема кризиса воспроизводимости поднимается в различных отраслях науки. Для такой деликатной темы, как регулирование продукции, предназначенной для потребления человеком, например, электронных сигарет, этот вопрос особенно актуален. Поэтому в рамках проекта Replica была поставлена задача повторить исследования in vitro, которые привели к выводам, представляющим значительный интерес, чтобы опровергнуть или подтвердить их достоверность5,6. В данном исследовании была повторена работа Радда и коллег7 , в которой сравнивалась in vitro токсичность аэрозоля электронной сигареты myblu с токсичностью дыма горючих сигарет. Они провели стандартную токсикологическую батарею из трех анализов, используемых для оценки продукции и нормативных документов: NRU-анализ для оценки цитотоксичности8 , анализ бактериальной обратной мутации (Эймса) для оценки мутагенности9 и микроядерный анализ in vitro для измерения генотоксичности10. Результаты исследования показали, что аэрозоль электронных сигарет обладает низкой цитотоксичностью, не проявляет мутагенной и генотоксической активности, в отличие от сигаретного дыма 3R4F, который проявляет высокую цитотоксическую, мутагенную и генотоксическую активность.
Несмотря на некоторые отличия в методологических аспектах нашего исследования, мы получили результаты, сходные с результатами, полученными Rudd и соавт. Основными методологическими отличиями были: (i) использование эталонной сигареты 1R6F вместо эталонной сигареты 3R4F, поскольку последняя больше не производится Центром эталонных табачных изделий (Университет Кентукки); (ii) разное оборудование для курения и вейпинга. Наша лаборатория оборудована отдельными аппаратами — курительной машиной LM1 и вейп-машиной LM4E (Borgwaldt, Гамбург, Германия). Вместо этого Радд и коллеги использовали пятипортовую установку SAEIVS для курения и вейпинга, которая генерировала как дым, так и аэрозоль. Кроме того, аппарат SAEIVS способен разбавлять дым/аэрозоль воздухом, в то время как аппараты LM1 и LM4E не предназначены для такого разбавления; (iii) различные системы воздействия дыма/аэрозоля на ALI in vitro. Система воздействия дыма/аэрозоля in vitro (SAEIVS), использованная Раддом и коллегами, была предназначена для воздействия на клетки в 96 и 24 многолуночных планшетах, только в последнем случае со вставками Transwell. Наша же система воздействия ALI in vitro (описанная в разделе «Методы») позволяет экспонировать клетки со вставками Transwell любого диаметра за счет использования специальной экспозиционной камеры. Все эти различия были устранены путем внесения некоторых изменений в протоколы, использованные в оригинальной работе, как описано в разделе «Методы».
Анализ NRU проводился как в LAB-A, так и в LAB-B. Наши результаты подтвердили более высокую цитотоксичность сигаретного дыма 1R6F по сравнению с аэрозолем электронных сигарет, как это было показано Rudd и коллегами. Однако рассчитанное значение EC50 для дыма 1R6F (1,71 затяжки) отличалось от значения, полученного в оригинальной работе (0,236 затяжки). Кроме того, мы не наблюдали такого же цитотоксического эффекта для аэрозоля myblu. Действительно, низкая цитотоксичность, индуцированная аэрозолем myblu, не позволила нам рассчитать значение EC50. Но мы наблюдали лишь снижение жизнеспособности клеток, около 80% жизнеспособности, начиная с 80 затяжек и заканчивая 140 затяжками. Эти различия в результатах могут быть связаны с разными аппаратами воздействия ALI. Радд и коллеги облучали клетки BEAS-2B, посеянные в 96-луночный планшет, но при таком облучении клетки не имеют среды на базальной поверхности клеток. Тогда это не настоящее ALI-облучение, поскольку клетки оказываются сухими, так как для проведения воздушно-интерфейсного облучения берется апикальная среда. В результате часть цитотоксичности, наблюдаемой Раддом и коллегами, может быть обусловлена условиями, которые не являются оптимальными для нормального состояния клеток. Напротив, мы экспонировали клетки BEAS-2B с помощью вставок Transwell, помещенных в экспозиционную камеру, заполненную культуральной средой в базальном отсеке, которая обеспечивает питание клеток через мембрану Transwell. Этот экспонирующий аппарат обеспечивает оптимальную среду, позволяющую избежать высыхания клеток, особенно при проведении длительных экспозиций (в данном случае от 10 до 77 мин). Такая же система ALI-облучения в сочетании с оценкой цитотоксичности успешно использовалась в наших предыдущих работах[11],[12],[13],[14], а также в других опубликованных работах[15],[16]. Более того, в ряде исследований токсичности in vitro использовалось воздействие ALI на клеточные культуры с помощью соответствующих аппаратов, разработанных специализированными производителями, таких как VITROCELL и CULTEX, которые имитируют реальные условия воздействия in vivo[17],[18]. Кроме того, мы добавили морфологическую оценку клеток в период восстановления через 24, 48 и 65 ч (рис. S1 и S2 в дополнительном материале). Этот набор экспериментов показал хорошее восстановление клеток с течением времени, хотя мы наблюдали некоторые расхождения в результатах анализа на NRU по сравнению с морфологическими данными. Однако, как показало наше предыдущее исследование, NRU может иметь некоторые ограничения в обнаружении апоптотических клеток[14] , особенно на ранней стадии этого процесса.
Тест Эймса проводился только в LAB-A, как сообщали Радд и коллеги, со штаммами Salmonella typhimurium TA98 и TA100, которые особенно актуальны для табачных изделий, поскольку доказана их чувствительность к продуктам горения19,20. В отличие от оригинальной работы, мы проводили тест Эймса с активацией метаболизма S9 и без нее. Наши результаты показали, что ни TA98, ни TA100 с S9 и без него не проявили мутагенного ответа после воздействия аэрозоля myblu даже при высоких дозах (от 60 до 300 затяжек), в отличие от того, что наблюдалось для сигаретного дыма 1R6F при малых дозах (от 9 до 45 затяжек). Эти результаты согласуются с тем, что показали в своей работе Радд и коллеги, хотя мы использовали другие аппараты для воздействия. Оценка мутагенности аэрозоля электронных сигарет методом анализа Эймса также была описана в литературе с результатами, сходными с теми, которые были получены в данной работе[21],[22],[23],[24].
Оценка генотоксичности проводилась в лаборатории LAB-A по методике, аналогичной той, о которой сообщали Радд и коллеги, за следующими исключениями: (i) мы добавили оценку генотоксичности без метаболической активации S9, чтобы улучшить их результаты; (ii) воздействие сигаретного дыма 1R6F проводилось в неразбавленном виде. Однако, следуя их протоколу, мы столкнулись с некоторыми методологическими проблемами. Действительно, они указали, что используют смесь S9 в концентрации 10%, но при использовании той же концентрации мы наблюдали массовую гибель клеток (более 50%), особенно для сигаретного дыма 1R6F, что повлияло на наблюдение микроядер в клетках V79. Вместо этого мы смогли провести оценку микроядер с помощью S9 для клеток V79, подвергшихся воздействию аэрозоля myblu, и не обнаружили генотоксического эффекта. На основании литературных данных мы установили, что смесь S9 обладает полным набором метаболических ферментов печени, но при этом проявляет высокую цитотоксичность в клеточных анализах[4]. В связи с этим мы построили кривую «доза-ответ» с различными концентрациями смеси S9 (от 1 до 5%) и увидели, что жизнеспособность клеток снижается с увеличением процентного содержания ферментной смеси S9 (рис. S4). Вероятно, высокий уровень цитотоксичности, наблюдаемый в ИВМН-тесте с S9, обусловлен суммой цитотоксичности неразбавленного цельного дыма в дополнение к цитотоксичности ферментной смеси S9. Ограничением анализа IVMN является то, что более высокие уровни цитотоксичности могут вызывать повреждение хромосом как вторичный эффект цитотоксичности, поэтому рекомендуется не превышать 50% цитотоксичности[10]. Действительно, анализ IVMN без метаболической активации S9 позволил нам подсчитать количество микроядер как для сигаретного дыма 1R6F, так и для аэрозоля myblu. Высокая генотоксичность (превышающая положительный контроль) была продемонстрирована для сигаретного дыма 1R6F при 1 затяжке, хотя четкого дозового ответа, обусловленного цитотоксическим действием сигаретного дыма 1R6F, не наблюдалось. Поэтому результаты генотоксичности для дыма 1R6F нельзя считать достоверными из-за обнаруженной высокой цитотоксичности. Однако при всех условиях воздействия миблу генотоксичность не наблюдалась. С нашими результатами согласуется работа Thorne et al. (2019), в которой показана самая высокая реактивность клеток V79 на горючую сигарету[25]. В другом исследовании изучалась генотоксическая активность аэрозольных электронных жидкостей на трех иммортализованных клеточных линиях, не включенных в рекомендации ОЭСР[26] , и было отмечено, что в определенных условиях и при наличии некоторых химических ароматизаторов жидкости для электронных сигарет способны вызывать генотоксичность. Более того, исследователи сообщили, что при минимальной рекомендованной дозе S9 вызывал значительную гибель клеточных линий, использованных в исследовании. В другом исследовании, посвященном изучению мутагенного и генотоксического потенциала различных химических ароматизаторов, используемых в электронных жидкостях[27] , для некоторых из них в высоких концентрациях наблюдалась определенная мутагенная активность в отношении штаммов S. typhimurium TA100 и TA98, но не для большинства из них. В другом случае тест IVMN в клетках CHO-K1 показал некоторое увеличение числа микроядер для небольшого числа химических ароматизаторов и при высоких концентрациях, как с фракцией S9, так и без нее. Однако все эти исследования проводились с использованием самодельных систем и без соблюдения стандартного валидированного режима воздействия, что затрудняет их воспроизведение другими группами. Все эти научные данные о мутагенном и генотоксическом действии аэрозолей электронных сигарет подчеркивают отсутствие ясности в этой области и необходимость проведения дальнейших исследований, соответствующих официальным рекомендациям и воспроизводимых для верификации результатов.
В заключение следует отметить, что наши результаты подтвердили результаты Rudd и соавт. о низком профиле токсичности электронной сигареты myblu, несмотря на некоторые различия в методологии. Кроме того, в нашем исследовании были устранены некоторые методологические пробелы и ограничения оригинальной работы, включая неоптимальную экспозицию ALI для оценки цитотоксичности и улучшение результатов по мутагенности и генотоксичности путем добавления экспериментов без активации метаболизма S9, как это рекомендовано в руководстве OECD. В целом данное повторное исследование подтверждает стратегию снижения вреда от табака как потенциально способную существенно снизить воздействие токсичных продуктов сгорания на взрослых курильщиков. Необходимы дальнейшие исследования для совершенствования методов in vitro с целью оценки долгосрочных эффектов электронных систем доставки никотина.
Методы
Тестовые продукты
В отличие от Радда и коллег, мы использовали эталонные сигареты 1R6F (Университет Кентукки, Центр эталонных табачных изделий, Лексингтон, штат Калифорния, США), поскольку 3R4F больше не производятся Университетом Кентукки. Эталонные горючие сигареты 1R6F и 3R4F очень похожи, и лишь незначительные различия были отмечены в химическом составе дыма и в анализах in vitro28. Перед каждой экспериментальной сессией горючие сигареты 1R6F кондиционировались в течение минимум 48 ч при температуре 22 ± 1 °C и относительной влажности 60 ± 3% в соответствии с ISO 3402:199929.
Для повторного исследования использовалась та же электронная сигарета, которую применяли Радд и коллеги, — myblu (Imperial Brands PLC, Бристоль, Великобритания). Электронная сигарета myblu представляет собой «закрытую капсульную систему», состоящую из двух элементов: перезаряжаемого аккумулятора (емкость аккумулятора 350 мАч) и сменной капсулы с электронной жидкостью объемом 1,5 мл и сопротивлением спирали 1,3 Ом (картомайзер). Для экспериментов использовались электронные жидкости со вкусом табака и содержанием никотина 1,6% (масс./масс.). Все электронные сигареты myblu и капсулы myblu были приобретены в итальянских розничных магазинах.
Воздействие дыма и пара
Выбранные продукты тестировались на стандартизированном оборудовании, имитирующем рельеф курения: на курительной машине LM1 (Borgwaldt, Гамбург, Германия) (рис. S6A) курились горючие сигареты 1R6F в режиме Health Canada Intense (HCI) (объем, продолжительность и частота затяжек 55 мл, 2 с и 30 с (55/2/30), с колоколообразным профилем, 27.LM1 является системой прямого воздействия и не производит разбавления дыма, в отличие от курительной машины, использованной Раддом и коллегами. Вейпинг-машина LM4E (Borgwaldt, Гамбург, Германия) (рис. S6B) использовалась для вейпинга миблу по схеме «CORESTA Reference Method n. 81» (CRM81) (объем затяжки 55 мл, затягивается в течение 3 с, раз в 30 с, профиль квадратной формы, скорость затяжки 18,3 мл/с), аккредитованной в ISO 20 768:201831. Стандартное время вытяжки для LM1 и LM4E составляло 0,7 с при скорости потока в камере воздействия 78,57 мл/с.
Рисунок 6
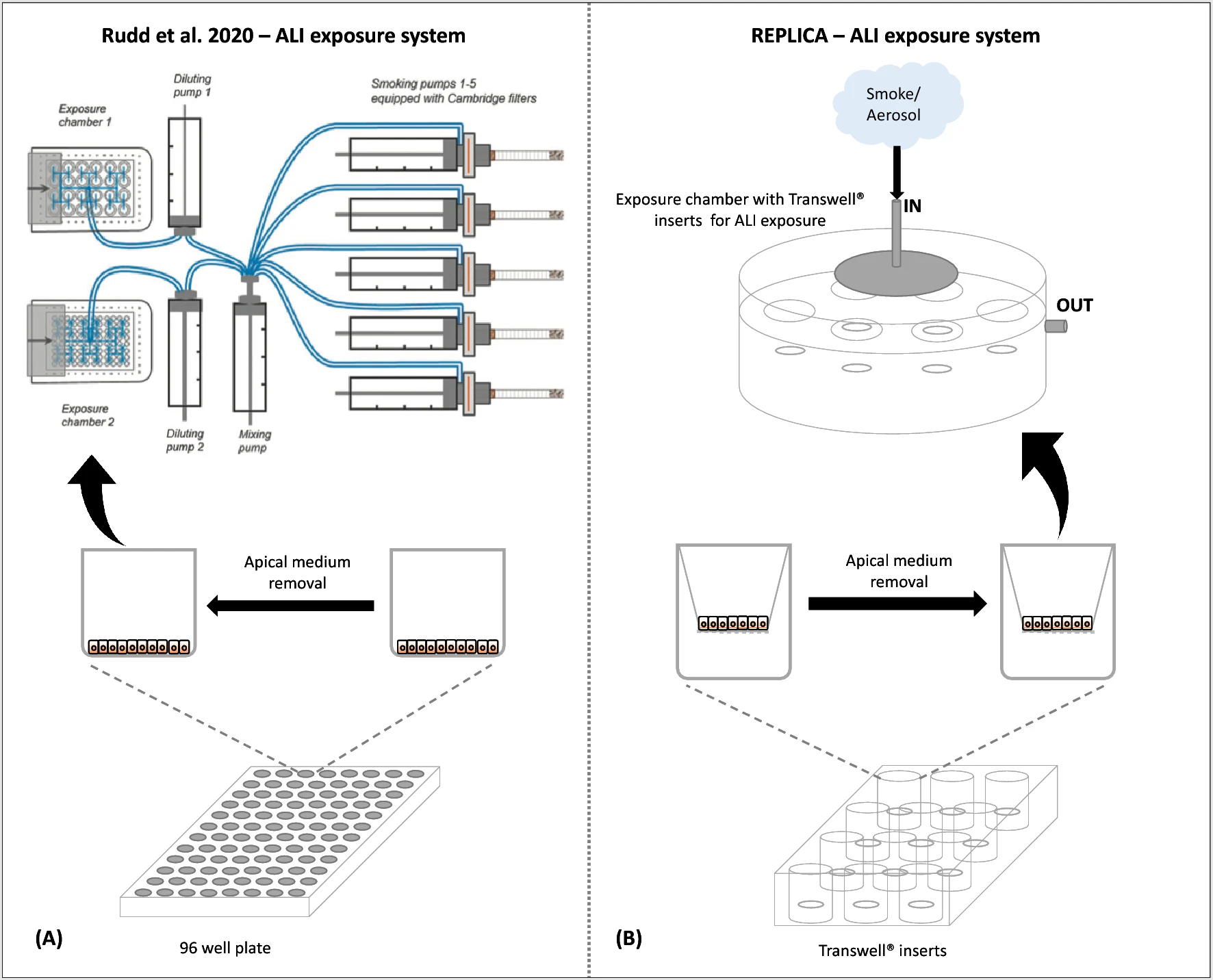
Для оценки цитотоксичности BEAS-2B сигаретный дым 1R6F подавался в неразбавленном виде от 1 до 8 затяжек (время экспозиции от 00:02 до 03:46 мм:сс). Аэрозоль миблу подавался в неразбавленном виде от 20 до 140 затяжек (время экспозиции от 10:30 до 76:30 мм:сс), как описано в работе Rudd et al. (2020). Для определения EC50 клеток V79, подвергшихся воздействию неразбавленного дыма 1R6F перед проведением анализа IVMN, была также проведена оценка цитотоксичности. В этом случае клетки V79 подвергались воздействию дыма 1R6F от 2 до 30 затяжек (время воздействия с 00:34 до 15:30 мм:сс). Исходя из EC50, рассчитанного ранее для клеток V79 по результатам анализа NRU, для анализа IVMN мы проводили воздействие дымом 1R6F от 1 до 4 затяжек на клетки (время воздействия от 00:02 до 01:38 мм:сс). Аэрозоль myblu доставлялся в неразбавленном виде от 20 до 100 затяжек (время экспозиции от 10:30 до 54:30 мм:сс), как описано в работе Rudd et al. (2020). Эксперименты по изучению цитотоксичности были воспроизведены лабораторией из Италии (CoEHAR, Университет Катании, в дальнейшем именуемой LAB-A) и лабораторией из Омана (Университет Султана Кабуса, именуемой LAB-B).
Для проведения анализа Эймса сигаретный дым 1R6F и относительный контроль AIR, или аэрозоль myblu и относительный контроль AIR подавались на бактериальные суспензии, содержащиеся в соответствующих импинджерах, при комнатной температуре в условиях защиты от прямого света. Между затяжками дыма или аэрозоля делалась затяжка фильтрованным окружающим воздухом. Количество затяжек приведено в табл. S7 (дополнительный материал) как для воздействия 1R6F, так и для воздействия myblu. В частности, вход импинджера для воздействия дымом 1R6F был подключен к курительной машине LM1 (дым 1R6F) и к каналу LM4E, оснащенному 44-мм кембриджским фильтром (CFP) (AIR interpuff) с помощью двойного одностороннего клапана, тогда как вход импинджера для воздействия аэрозолем электронной сигареты myblu был подключен к двум различным каналам LM4E, один из которых был оснащен электронной сигаретой, а другой — 44-мм CFP (AIR interpuff).
Культуры клеток
Нормальные бронхиальные эпителиальные клетки (BEAS-2B / ATCC-CRL-9609) культивировали в колбах, покрытых коллагеном, с использованием среды для роста бронхиальных эпителиальных клеток, дополненной набором Lonza Bullet Kit (BEGM, Lonza CC-3170), в соответствии с инструкциями ATCC по культивированию. Клетки фибробластов легкого хомяка (V79 / ICLC-AL99002) культивировали в среде Дульбекко с высоким содержанием глюкозы (DMEM-hg, Thermo Fisher Scientific) с 10% FBS, 2 мМ L-глютамина, 50 U/mL пенициллина и 50 мкг/мл стрептомицина, как описано в инструкции ICLC (Interlab Cell Line Collection; http://bioinformatics.hsanmartino.it/iclc/).
Оценка цитотоксичности: NRU assay
Оценка цитотоксичности проводилась на клетках BEAS-2B с помощью NRU-теста8,32. Кроме того, перед оценкой генотоксичности для клеток V79 была проведена оценка цитотоксичности с использованием цельного дыма 1R6F, чтобы определить количество затяжек, используемых в анализе ИВМН.
Перед воздействием 300 мкл суспензии клеток BEAS-2B (BEGM, дополненной Lonza Bullet Kit и 20 мМ HEPES-буфером) высевали в 24-луночные Transwell-вставки при плотности 150.000 клеток/лунку и инкубировали в течение 20 ± 3 ч. После инкубации апикальную среду удаляли, а вставки Transwell переносили в соответствующую экспозиционную камеру, заполненную 25 мл DMEM-hg, дополненной 50 Ед/мл пенициллина и 50 мкг/мл стрептомицина, для проведения воздействия дымом/паром ALI. После воздействия ALI каждая вставка переносилась в новый 24-луночный планшет, заполненный 500 мкл и 300 мкл свежего BEGM (дополненного Lonza Bullet Kit + 20 мМ HEPES-буфера) соответственно в базальный и апикальный отсеки. Затем клетки инкубировали в течение периода восстановления 65 ± 2 ч7. За день до анализа NRU раствор NRU готовили в среде BEGM в соотношении 1:65 (0,05 г/л) плюс HEPES-буфер в концентрации 20 мМ и помещали в инкубатор при 37 °C 5% CO2. В день проведения NRU-анализа раствор NRU перед использованием фильтровали. Культуральную среду удаляли из апикального и базального отсеков каждой культуральной вставки. Клетки дважды промывали предварительно подогретым PBS, затем инкубировали с раствором нейтрального красного (500 мкл снизу и 300 мкл сверху) в течение 3 ч при 37 °C в 5% CO2 и увлажненной атмосфере. После инкубации клетки дважды промывали предварительно подогретым PBS для удаления неинкорпорированного красителя. Инкорпорированный раствор вымывался из клеток путем добавления 330 мкл раствора дестаина (50% этанола, 49% дистиллированной воды, 1% ледяной уксусной кислоты v:v:v) к каждой вставке и инкубировался в течение 10 мин при 300 об/мин на шейкере. Экстракты переносили в 96-луночный планшет в двух экземплярах (по 100 мкл на лунку) и считывали оптическую плотность нейтрально-красных экстрактов с помощью микропланшетного спектрофотометра при 540 нм с использованием референтного фильтра на 630 нм. Для оценки степени окрашивания мембран Transwell раствором нейтрального красного использовались пустые лунки (без клеток), из каждого измерения вычиталось среднее значение фона.
Аналогичная процедура была использована для оценки цитотоксичности клеток V79. Вкратце, 300 мкл суспензии клеток V79 (DMEM-hg, дополненная 10% FBS, 2 мМ L-глутамина, 50 Ед/мл пенициллина, 50 мкг/мл стрептомицина и 20 мМ HEPES) добавляли в 24-луночные Transwell-вставки при плотности 100.000 клеток/лунку и инкубировали в течение 24 ч. В день воздействия ALI вставки Transwell (без апикальной среды для культивирования клеток) переносились в соответствующую экспозиционную камеру, заполненную в базальном отсеке 25 мл DMEM-hg, дополненной 50 U/mL пенициллина и 50 мкг/мл стрептомицина. После воздействия ALI каждая вставка переносилась в новый 24-луночный планшет, заполненный 500 мкл и 300 мкл свежей DMEM-hg (дополненной 10% FBS, 2 мМ L-глютамина, 50 U/mL пенициллина, 50 мкг/мл стрептомицина и 20 мМ HEPES) соответственно в базальном и апикальном отсеках. Затем клетки инкубировали для восстановления в течение 24 ч. Раствор NRU готовили в DMEM-hg в соотношении 1:65 (0,05 г/л) плюс HEPES-буфер в концентрации 20 мМ. Дальнейшие этапы анализа NRU для клеток V79 были такими же, как и для BEAS-2B, и описаны выше. Для этого анализа были проведены три отрицательных контроля: (i) клетки содержались в инкубаторе с базальной и апикальной культуральной средой (INC), (ii) клетки содержались в инкубаторе без апикальной среды для воспроизведения воздействия на границу раздела воздух-жидкость (ALI) и (iii) клетки подвергались воздействию струи лабораторного воздуха, отфильтрованного от твердых частиц (AIR).
Оценка мутагенности: Анализ Эймса
Мутагенный эффект in vitro свежего дыма 1R6F и аэрозолей myblu определяли с помощью теста Эймса33 , описанного Rudd et al.7 с некоторыми изменениями, и проводили его только в лаборатории LAB-A. В тесте Эймса использовались только штаммы S. typhimurium TA98 и TA100 (Trinova Biochem GmbH) ± обработка S9, которые наиболее чувствительны к продуктам горения. Анализ по Эймсу проводился в соответствии с руководством по испытаниям ОЭСР (Организация экономического сотрудничества и развития) 4719.
Вкратце, культуры бактерий штаммов TA98 и TA100 готовили в 25 мл питательного бульона № 2 (OXOID) путем инокуляции одной бактерии с последующей инкубацией в течение ночи при 37 °C со встряхиванием при 120 об/мин. Затем готовили бактериальную суспензию путем центрифугирования 25 мл культуры при 1800 g в течение 20 мин при 4 °C и ресуспендировали гранулу в 12 мл фосфатно-забуференного солевого раствора Дульбекко (PBS), не содержащего Ca2+, Mg2+. Затем 10 мл бактериальных суспензий помещали в соответствующие импинджеры и подвергали воздействию тестовых аэрозолей/дыма и фильтрованного окружающего воздуха (отрицательный контроль воздействия), как описано выше (подвергнутая воздействию бактериальная суспензия или eBS). Для каждого эксперимента в качестве внутренних отрицательных контролей (контроль растворителя) использовалась аликвота PBS с необработанной бактериальной суспензией PBS (для анализа без смеси S9) и смесь S9 с необработанной бактериальной суспензией PBS (для анализа со смесью S9).
После каждой экспозиции бактериальные суспензии сразу же использовались для скрининга по Эймсу в соответствии с протоколом производителя (Salmonella Mutagenicity Test Kit, MOLTOX®). Вкратце, аликвоту бактериальной суспензии и соответствующие реагенты добавляли в стерильные пробирки объемом 15 мл, как описано в табл. S8 (дополнительный материал). Раствор тщательно перемешивали, затем сцеживали на пластину агара с минимальным содержанием глюкозы, накрывали и отставляли в сторону для застывания. После застывания верхнего слоя агара пластины переворачивали и помещали в инкубатор при температуре 37 °C. Через 48-72 ч инкубации вручную подсчитывали количество выросших на пластинах колоний ревертантов.
Мутагены Controlchem™ использовались в качестве положительного контроля для штаммов S. typhimurium TA98 и TA100 (см. табл. S9 дополнительного материала). Каждая концентрация тестовых аэрозолей или дыма и положительных контролей тестировалась в трех экземплярах.
Оценка генотоксичности: Анализ IVMN
Анализ IVMN проводился в соответствии с руководством по испытаниям OECD № 487 10. 487 10 с метаболической активацией S9 и без нее, и проводился только в LAB-A. Оценка генотоксичности свежего табачного дыма и аэрозоля электронных сигарет проводилась с использованием клеточной линии легких хомяка V79 (Interlab Cell Line Collection (ICLC)-AL99002). За день до воздействия клетки V79 высевали в 24-луночные Transwell-вставки (мембрана с порами 0,4 мкм) при плотности 10 × 104 в 200 мкл DMEM-hg, дополненной 10% FBS. Во внутренние лунки каждого 24-луночного планшета вносили по 500 мкл DMEM-hg, дополненной 10% FBS. Клетки V79 инкубировали в течение 24 ч при 37 °C и 5% CO2. Через 24 ч инкубации апикальную среду удаляли, а вставки переносили в экспозиционную камеру, заполненную 25 мл DMEM-hg с добавлением HEPES-буфера (конечная концентрация 20 мМ) в базальном отсеке. Воздействие дыма 1R6F и аэрозоля электронной сигареты myblu описано в предыдущем разделе «Воздействие дыма и паров». После воздействия каждая вставка переносилась в новый 24-луночный планшет, заполненный 500 мкл DMEM-hg, дополненной HEPES-буфером (20 мМ). Для проведения ИВМН с S9 каждый вкладыш, содержащий экспонированные клетки V79, заполняли 300 мкл смеси S9 в концентрации 10% в апикальном отсеке и инкубировали в течение 3 ч при 37°С. После инкубации апикальную среду с S9 удаляли, клетки V79 покрывали средой DMEM-hg, дополненной HEPES-буфером (20 мМ), и инкубировали в течение 24 ч, чтобы обеспечить по крайней мере один цикл клеточного деления. Для IVMN без S9 вставки с обнаженными клетками V79 заливались DMEM-hg, дополненным HEPES-буфером (20 мМ), и инкубировались в течение 24 ч при 37 °С и 5% CO2. Для ИВМН с активацией S9 и без нее были проведены три негативных контроля: (i) клетки содержались в инкубаторе с базальной и апикальной культуральной средой (INC), (ii) клетки содержались в инкубаторе без апикальной среды для воспроизведения воздействия на границу раздела воздух-жидкость (ALI) и (iii) клетки подвергались воздействию струй лабораторного воздуха, отфильтрованного от твердых частиц (AIR). В качестве положительных контролей использовались циклофосфамид А (CAS 6055-19-2) для фракции S9 и митомицин С (CAS 50-07-7) для IVMN без S9. Все исследуемые условия оценивались в трех экземплярах.
Через 24 ч после восстановления клетки отделяли и подсчитывали на анализаторе Muse® Cell Analyzer с использованием набора Muse® Count & Viability Kit (Luminex Corp.). Затем клетки V79 высевали в 96-луночный планшет (CellCarrier Ultra-96 Black, Optically Clear Bottom-PerkinElmer) при плотности 10 × 103 на лунку и инкубировали в течение 24 ч. Далее клетки фиксировали 4%-ным параформальдегидом (PFA) в течение 20 мин при комнатной температуре. После фиксации клетки однократно промывали PBS и окрашивали DAPI (1 мкг/мл). Оценка микроядер проводилась с помощью программы Harmony® High-Content Imaging and Analysis Software (PerkinElmer).
Статистика
Все исходные данные собирались и обрабатывались с помощью программы Excel (Microsoft, Redmond, WA, USA). Для оценки воспроизводимости данных NRU между LAB-A и LAB-B использовали R версии 3.4.3 (2017-11-30). Воспроизводимость данных NRU, полученных в LAB-A и LAB-B, оценивали с помощью линейного регрессионного анализа процентов жизнеспособности клеток (к контролю AIR) между двумя лабораториями. Кроме того, для оценки согласия между LAB-A и LAB-B рассчитывали средние различия и границы согласия (95% доверительный интервал), которые визуализировали с помощью графиков Бланда-Альтмана. Для оценки отличий средних между двумя лабораториями от нуля также был проведен выборочный Т-тест с одним хвостом (табл. S10 и рис. S5 дополнительных материалов).
Для оценки цитотоксичности (NRU) данные выражались в процентах к контролю AIR. Значения EC50 для каждого воздействия (1R6F и myblu) рассчитывались путем подгонки сигмоидальной кривой доза-ответ с переменным наклоном для определения наилучшего соответствия для модели нелинейной регрессии 1R6F log EC50 7 параметров и для модели нелинейной регрессии myblu log EC50 7 параметров. Кроме того, сравнение результатов myblu и контроля AIR проводилось с помощью ANOVA с последующим post hoc тестом множественных сравнений Даннетта.
Данные анализа Эймса (оценка мутагенности) были представлены в виде изменения в разах по отношению к контролю AIR[3] и рассчитаны следующим образом:
(количество ревертантов по отношению к количеству затяжек) — (среднее количество ревертантов по отношению к контролю AIR)/среднее количество ревертантов по отношению к контролю AIR
- Реверта́нт — мутант, у которого в результате обратной, супрессорной или компенсаторной мутации полностью или частично восстанавливаются признаки исходного организма.
Для оценки мутагенной активности каждого штамма проводился линейный регрессионный анализ. Кроме того, сравнение между 1R6F и соответствующими контролями, а также между myblu и соответствующими контролями проводили с помощью модели смешанных эффектов или ANOVA с последующим post hoc тестом множественных сравнений Тьюки.
Данные по генотоксичности анализировали с помощью линейной регрессии наклонов дозового отклика 1R6F или myblu с последующим сравнением наклонов. Сравнение между различными дозами дыма или аэрозоля и соответствующими контролями проводили с помощью ANOVA и последующих тестов множественного сравнения Tukey’s (IVMN без активации S9) или Dunnett’s (IVMN с активацией S9) post hoc.
Все анализы считались значимыми при значении p < 0,05. Для анализа данных и построения графиков использовалось программное обеспечение GraphPad Prism 8, если не указано иное. Исходные данные были предоставлены в репозиторий Zenodo (https://doi.org/10.5281/zenodo.8335201).
Дополнительная информация
Все эксперименты проводились в соответствии с действующими инструкциями и правилами. В экспериментах не использовались животные и образцы тканей человека. Для экспериментов по изучению цитотоксичности использовались клетки из Американской коллекции типовых культур (Manassas, VA, USA): Нормальные бронхиальные эпителиальные клетки человека (BEAS-2B / ATCC-CRL-9609). Для оценки генотоксичности использовали клеточную линию V79 легкого хомяка (ICLC-AL99002) из IRCCS Ospedale Policlinico San Martino, (Interlab Cell Line Collection-ICLC).
Доступность данных
Наборы данных, полученных в ходе настоящего исследования, можно получить у соответствующего автора по обоснованному запросу.
Ссылки
- European Commission. Tobacco Products Directive (TPD) 2014/40/EU, https://health.ec.europa.eu/tobacco/product-regulation/implementing-tobacco-products-directive-directive-201440eu/revision-tobacco-products-directive_en (2014).
- Marques, P., Piqueras, L. & Sanz, M. J. An updated overview of e-cigarette impact on human health. Respir. Res. 22, 151. https://doi.org/10.1186/s12931-021-01737-5 (2021).Article CAS PubMed PubMed Central Google Scholar
- Levy, D. D. et al. Recommended criteria for the evaluation of bacterial mutagenicity data (Ames test). Mutat. Res. Genet. Toxicol. Environ. Mutagen. 848, 403074. https://doi.org/10.1016/j.mrgentox.2019.07.004 (2019).Article CAS PubMed Google Scholar
- Ooka, M., Lynch, C. & Xia, M. Application of in vitro metabolism activation in high-throughput screening. Int. J. Mol. Sci. 21, 52 (2020).Article Google Scholar
- Baker, M. 1,500 scientists lift the lid on reproducibility. Nature 533, 452–454. https://doi.org/10.1038/533452a (2016).Article ADS CAS PubMed Google Scholar
- Serra-Garcia, M. & Gneezy, U. Nonreplicable publications are cited more than replicable ones. Sci. Adv. https://doi.org/10.1126/sciadv.abd1705 (2021).Article PubMed PubMed Central Google Scholar
- Rudd, K. et al. Chemical composition and in vitro toxicity profile of a pod-based E-cigarette aerosol compared to cigarette smoke. Appl. In Vitro Toxicol. https://doi.org/10.1089/aivt.2019.0015 (2020).Article Google Scholar
- Borenfreund, E. & Puerner, J. A. Toxicity determined in vitro by morphological alterations and neutral red absorption. Toxicol. Lett. 24, 119–124. https://doi.org/10.1016/0378-4274(85)90046-3 (1985).Article CAS PubMed Google Scholar
- OECD. Test No. 471: Bacterial Reverse Mutation Test, OECD Guidelines for the Testing of Chemicals, Section 4. https://www.oecd-ilibrary.org/environment/test-no-471-bacterial-reverse-mutation-test_9789264071247-en (1997).
- OECD. Test No. 487: In Vitro Mammalian Cell Micronucleus Test, OECD Guidelines for the Testing of Chemicals, Section 4. https://www.oecd-ilibrary.org/environment/test-no-487-in-vitro-mammalian-cell-micronucleus-test_9789264264861-en (2016).
- Caruso, M. et al. Role of cigarette smoke on angiotensin-converting enzyme-2 protein membrane expression in bronchial epithelial cells using an air-liquid interface model. Front. Pharmacol. 12, 652102. https://doi.org/10.3389/fphar.2021.652102 (2021).Article CAS PubMed PubMed Central Google Scholar
- Caruso, M. et al. In vitro cytoxicity profile of e-cigarette liquid samples on primary human bronchial epithelial cells. Drug Test Anal. https://doi.org/10.1002/dta.3275 (2022).Article PubMed Google Scholar
- Caruso, M. et al. Electronic nicotine delivery systems exhibit reduced bronchial epithelial cells toxicity compared to cigarette: The Replica Project. Sci. Rep. 11, 24182. https://doi.org/10.1038/s41598-021-03310-y (2021).Article ADS CAS PubMed PubMed Central Google Scholar
- Caruso, M. et al. Screening of different cytotoxicity methods for the assessment of ENDS toxicity relative to tobacco cigarettes. Regul. Toxicol. Pharmacol. 125, 105018. https://doi.org/10.1016/j.yrtph.2021.105018 (2021).Article CAS PubMed Google Scholar
- Azzopardi, D. et al. Evaluation of an air-liquid interface cell culture model for studies on the inflammatory and cytotoxic responses to tobacco smoke aerosols. Toxicol. In Vitro 29, 1720–1728. https://doi.org/10.1016/j.tiv.2015.06.016 (2015).Article CAS PubMed Google Scholar
- Azzopardi, D. et al. Electronic cigarette aerosol induces significantly less cytotoxicity than tobacco smoke. Toxicol. Mech. Methods 26, 477–491. https://doi.org/10.1080/15376516.2016.1217112 (2016).Article CAS PubMed PubMed Central Google Scholar
- Czekala, L. et al. Toxicological comparison of cigarette smoke and e-cigarette aerosol using a 3D in vitro human respiratory model. Regul. Toxicol. Pharmacol. 103, 314–324. https://doi.org/10.1016/j.yrtph.2019.01.036 (2019).Article CAS PubMed Google Scholar
- Thorne, D., Larard, S., Baxter, A., Meredith, C. & Gaҫa, M. The comparative in vitro assessment of e-cigarette and cigarette smoke aerosols using the γH2AX assay and applied dose measurements. Toxicol. Lett. 265, 170–178. https://doi.org/10.1016/j.toxlet.2016.12.006 (2017).Article CAS PubMed Google Scholar
- Hollings, M., Seymour, A., Woodhams, A., Ballantyne, M. & Clements, J. in TSRC, Tob. Sci. Res. Conf., 2016, 70, abstr. 13 (CORESTA, 2016).
- Préfontaine, D., Morin, A., Jumarie, C. & Porter, A. In vitro bioactivity of combustion products from 12 tobacco constituents. Food Chem. Toxicol. 44, 724–738. https://doi.org/10.1016/j.fct.2005.10.005 (2006).Article CAS PubMed Google Scholar
- Fowler, K., Fields, W., Hargreaves, V., Reeve, L. & Bombick, B. Development, qualification, validation and application of the Ames test using a VITROCELL(®) VC10(®) smoke exposure system. Toxicol. Rep. 5, 542–551. https://doi.org/10.1016/j.toxrep.2018.04.003 (2018).Article CAS PubMed PubMed Central Google Scholar
- Ishikawa, S., Kanemaru, Y., Nara, H., Erami, K. & Nagata, Y. Assessing the mutagenic activities of smoke from different cigarettes in direct exposure experiments using the modified Ames Salmonella assay. Mutat. Res. Genet. Toxicol. Environ. Mutagen. 803–804, 13–21. https://doi.org/10.1016/j.mrgentox.2016.04.008 (2016).Article CAS PubMed Google Scholar
- Thorne, D., Breheny, D., Proctor, C. & Gaca, M. Assessment of novel tobacco heating product THP1.0. Part 7: Comparative in vitro toxicological evaluation. Regul. Toxicol. Pharmacol. 93, 71–83 (2018).Article CAS PubMed Google Scholar
- Thorne, D. et al. The mutagenic assessment of an electronic-cigarette and reference cigarette smoke using the Ames assay in strains TA98 and TA100. Mutat. Res. Genet. Toxicol. Environ. Mutagen. 812, 29–38. https://doi.org/10.1016/j.mrgentox.2016.10.005 (2016).Article CAS PubMed Google Scholar
- Thorne, D. et al. Genotoxicity evaluation of tobacco and nicotine delivery products: Part Two. In vitro micronucleus assay. Food Chem. Toxicol. 132, 110546. https://doi.org/10.1016/j.fct.2019.05.054 (2019).Article CAS PubMed Google Scholar
- Tellez, C. S. et al. Cytotoxicity and genotoxicity of E-cigarette generated aerosols containing diverse flavoring products and nicotine in oral epithelial cell lines. Toxicol. Sci. 179, 220–228. https://doi.org/10.1093/toxsci/kfaa174 (2021).Article CAS PubMed Google Scholar
- Barhdadi, S. et al. Identification of flavouring substances of genotoxic concern present in e-cigarette refills. Food Chem. Toxicol. 147, 111864. https://doi.org/10.1016/j.fct.2020.111864 (2021).Article CAS PubMed Google Scholar
- Jaccard, G. et al. Mainstream smoke constituents and in vitro toxicity comparative analysis of 3R4F and 1R6F reference cigarettes. Toxicol. Rep. 6, 222–231. https://doi.org/10.1016/j.toxrep.2019.02.009 (2019).Article CAS PubMed PubMed Central Google Scholar
- International Organization for Standardization. ISO 3402:1999. https://www.iso.org/cms/render/live/en/sites/isoorg/contents/data/standard/02/83/28324.html (1999).
- ISO International Organization for Standardization. ISO/TR 19478-2:2015 ISO and Health Canada intense smoking parameters—part 2: Examination of factors contributing to variability in the routine measurement of TPM, water and NFDPM smoke yields of cigarettes. https://www.iso.org/standard/67470.html (2015).
- ISO International Organization for Standardization. ISO 20768:2018 Vapour products-Routine analytical vaping machine-Definitions and standard conditions. https://www.iso.org/standard/69019.html (2018).
- Repetto, G., del Peso, A. & Zurita, J. L. Neutral red uptake assay for the estimation of cell viability/cytotoxicity. Nat. Protoc. 3, 1125–1131. https://doi.org/10.1038/nprot.2008.75 (2008).Article CAS PubMed Google Scholar
- Maron, D. M. & Ames, B. N. Revised methods for the Salmonella mutagenicity test. Mutat. Res. 113, 173–215. https://doi.org/10.1016/0165-1161(83)90010-9 (1983).Article CAS PubMed Google Scholar
Концептуализация: М.К., Г.Л.В.; Методология: Р.Е., В.Ф., Ф.З., М.К., Г.Л.В.; Формальный анализ: Р.Е.; Исследование: R.E., V.F., A.D., K.P., M.A.T., R.Z., Z.A., R.Pu.; Ресурсы: S.R.; Обработка данных: Р.Е.; Написание — подготовка первоначального варианта: R.E., K.P.; написание — рецензирование и редактирование: P.M.F., R.Po., A.S., M.C., G.L.V., RPG#; Валидация: А.С.; Наблюдение: М.К., Г.Л.В.
Корреспондирующий автор
Корреспонденция Массимо Карузо.
Этические декларации
Конкурирующие интересы
Риккардо Полоза — штатный профессор кафедры внутренней медицины Университета Катании (Италия) и медицинский директор Института внутренней медицины и клинической иммунологии того же университета. Он получил гранты от U-BIOPRED и AIR-PROM, Integral Rheumatology & Immunology Specialists Network (IRIS), Foundation for a Smoke Free World, Pfizer, GlaxoSmithKline, CV Therapeutics, NeuroSearch A/S, Sandoz, Merk Sharp & Dohme, Boehringer Ingelheim, Novartis, Arbi Group Srl, Duska Therapeutics, Forest Laboratories, Ministero dell Universita’ e della Ricerca (MUR) Bando PNRR 3277/2021 (CUP E63C22000900006) и 341/2022 (CUP E63C22002080006), финансируемые NextGenerationEU Европейского Союза (ЕС), и министерский грант PON REACT-EU 2021 GREEN- Bando 3411/2021 от Ministero dell Universita’ e (MUR) — PNRR EU Community. Он является основателем Центра профилактики и лечения табачной зависимости (CPCT) при Университете Катании и Центра передового опыта по ускорению снижения вреда при том же университете. Получает гонорары за консультации от компаний Pfizer, Boehringer Ingelheim, Duska Therapeutics, Forest Laboratories, CV Therapeutics, Sermo Inc., GRG Health, Clarivate Analytics, Guidepoint Expert Network и GLG Group. Получает гонорары за учебники от компании Elsevier. Он также участвует в подаче патентной заявки для компании ECLAT Srl. На общественных началах он является научным консультантом Lega Italiana Anti Fumo (LIAF) и Международной сети организаций потребителей никотина (INNCO), а также председателем Европейского технического комитета по стандартизации «Требования и методы испытаний на выбросы электронных сигарет» (CEN/TC 437; WG4). В настоящее время Джованни Ли Вольти является избранным директором Центра передового опыта по ускорению снижения выбросов парниковых газов (CoEHAR). Другие авторы не имеют соответствующих финансовых интересов.
Дополнительная информация
Примечание издателя
Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий в опубликованных картах и институциональных аффилиаций.